
【题目】如图微粒的结构示意图,正确的是( )
A. Mg2+![]() B. Cl
B. Cl![]() C. Ar
C. Ar D. K
D. K![]()
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知:2H2O(l)=2H2(g)+O2(g) ΔH=+571.0kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
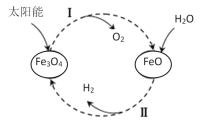
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2kJ/mol
过程Ⅱ:……
下列说法不正确的是( )
A.过程Ⅰ中每消耗232gFe3O4转移2mol电子
B.过程Ⅱ热化学方程式为:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=-128.9kJ/mol
C.过程Ⅰ、Ⅱ中能量转化的形式依次是:太阳能→化学能→热能
D.铁氧化合物循环制H2具有成本低、产物易分离等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上以12C作为确定原子量的标准。若把12C的原子量定为24,并规定把24g12C所含碳原子数定为阿伏伽德罗常数,用NA表示,则下列推论中正确的是( )
A.12g碳单质完全燃烧需要体积约为11.2L(标准状况)的氧气
B.44gCO2和28gCO含有相同数目的分子
C.NA个氧分子和1mol氢分子的质量之比为8:1
D.氧气的摩尔质量为64g/mol,所以32g氧气所含分子数目为3.01×1023个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,W在大气中有两种同素异形体且均能支持燃烧,X的原子半径是所有短周期主族元素中最大的,非金属元素Y的原子序数是Z的最外层电子数的2倍。下列叙述不正确的是( )
A.Y、Z的氢化物稳定性Y>Z
B.Y单质的熔点高于X单质
C.X、W、Z能形成具有强氧化性的XZW
D. 中W和Y都满足8电子稳定结构
中W和Y都满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有0.01 mol Cu,a mol Cu2O、b mol CuO的混合物中滴加6 mol·L-1的稀硝酸溶液至10ml时,固体恰好完全溶解,得到标准状况下224mL气体(纯净物)。下列说法正确的是
A.反应过程中转移0.01 mol电子B.a:b=1:1
C.被还原的硝酸为0.06 molD.将少量铁粉投入该稀硝酸中能生成Fe(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是( )
A.X、Y、Z、W的原子半径依次减小
B.W与X元素的单质在常温下不反应
C.W的气态氢化物的沸点一定低于Z的气态氢化物的沸点
D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将燃煤排放的含有SO2的烟气通入海水(主要含Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子)进行脱硫的工艺流程如图所示,下列说法中正确的是( )
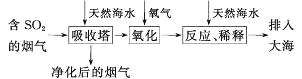
A. 天然海水显酸性
B. 氧化过程中可能发生的离子反应为2SO2+2H2O+O2=4H++2SO42-
C. 排入大海的溶液与天然海水相比,只有SO42-数量发生了变化
D. 若将氧化后的液体进行蒸发结晶,得到的晶体中CaSO4含量最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知氢有3种常见原子:11H、21H、31H(或H、D、T),氯有2种常见核素原子:35Cl、37Cl,氯气与氢气形成的氯化氢分子的相对分子质量有________种。
(2)质量相同的H216O和D216O所含质子数之比为______,中子数之比为________,电解产生的氢气在同温同压下体积之比为________,质量之比为________。
(3)2 g AO32-电子数比质子数多3.01×1022个,则A的相对原子质量为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com