
下列物质属于电解质的一组是 ( )
( )
A. CO2、氨水、H2SO4 B.熔融NaCl 、HNO3、H2O
C. KOH、BaCl2、Cu D.KNO3、盐酸、C2H5OH
科目:高中化学 来源:2016-2017学年河南省高一12月月考化学卷(解析版) 题型:实验题

(1)用不到的仪器 (填字母)
A.烧杯 |
B.托盘天平 |
C.量筒 |
D.胶头滴管 |
E.玻璃棒
F.500mL容量瓶;
(2)实验开始前需要检验容量瓶 ;
(3)需要量取浓硫酸的体积为 ;
(4)将量取的浓硫酸沿烧杯壁慢慢注入盛有适量水的烧杯中,并不断搅拌,然后________________;
(5)将上述烧杯中的硫酸溶液转移至容量瓶时,某实验小组同学操作的示意图如下。请你指出图中错误。_______________________;
(6)某实验小组其它操作均正确,但未用蒸馏水洗涤烧杯,则其所配制溶液的浓度 ;定容时若仰视刻度线,则所配制溶液的浓度____________(填“偏大”、“偏小”或“无影响”);
(7)溶液转移及洗涤完成后,应向容量瓶中直接加水到离刻度线下__________时,改用胶头滴管加水,使溶液的凹液面正好跟刻度线水平相切。
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期第二次月考化学试卷(解析版) 题型:选择题
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3 N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
2 H2(g)+ O2(g)= 2H2O(g) △H2
C(s)+ O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为
A.12△H3+5△H2-2△H1 B.2△H1-5△H2-12△H3
C.12△H3-5△H2 -2△H1 D.△H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中重点班高一12月考化学卷(解析版) 题型:选择题
下列离子方程式正确的是 ( )
A.将氯气通入氯化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl-
B.钠与水的反应:Na+2H2O=Na++
 2OH-+H2↑
2OH-+H2↑
C.氢氧化钡溶液与稀硫酸混合:Ba2++SO42- =BaSO4↓
D.金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中重点班高一12月考化学卷(解析版) 题型:选择题
下列实验中,所采取的分离方法与对应原理都正确的是( )
选项 | 目的 | 分离方法 | 原理 |
A. | 分离溶于水的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
B. | 分离汽油和水 | 分液 | 汽油和水的密度不同 |
C. | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
D. | 除去乙醇中的水 | 蒸馏 | 乙醇与水的沸点不同 |
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中实验班高一12月考化学卷(解析版) 题型:填空题
明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:

(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S 2Al2O3+9SO2,该反应的氧化剂是___________;若生成1 mol Al2O3,则转移的电子数为__________________。
2Al2O3+9SO2,该反应的氧化剂是___________;若生成1 mol Al2O3,则转移的电子数为__________________。
(2)熟料溶解时,反应的离子方程式为________________。
(3)母液中溶质主要成分为__________。(填化学式)
(4)检验废渣中主要成分的方法:
①操作__________________________,
②现象__________________________,
③结论__________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中实验班高一12月考化学卷(解析版) 题型:选择题
在杠杆的两端分别挂着质量和体积都相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在氢氧化钠溶液和硫酸铜溶液中片刻,则下列说法正确的是( )
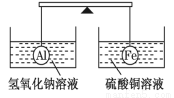
A.两烧杯中均无气泡产生 B.去掉两烧杯,杠杆右端下沉
C.去掉两烧杯,杠杆仍平衡 D.左边烧杯中的溶液质量减少了
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:填空题
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①可以判断该分解反应已经达到化学平衡的是___________。
A.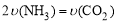
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:__________________________。
③氨基甲酸铵分解反应的焓变△H_________0,熵变△S________0(填>、<或=)。
(2)已知:NH2COONH4+2H 2O
2O NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始 浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。

计算25℃时,0~6min氨基甲酸铵水解反应的平均速率_______________________。
查看答案和解析>>
科目:高中化学 来源:2017届重庆市西北狼教育联盟高三12月月考化学试卷(解析版) 题型:推断题
【化学—选修5:有机化学基础】常用的油脂、蜡的漂白剂、化妆品助剂、橡胶硫化剂:C14H10O4。下面是以物质A为 原料合成C14H10O4,的流程:
原料合成C14H10O4,的流程:
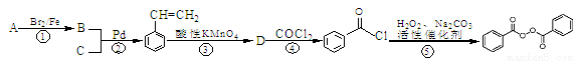
提示:①2010年赫克、根岸英一和铃木章因在“钯催化交叉偶联反应”研究领域作出了杰出贡献,而获得了诺贝尔化学奖,其反应机理可简单表示为:

②苯乙烯和甲苯与酸性KMnO4溶液反应产物相同。
请回答下列问题 :
:
(1)物质A的分子式为 ,物质C中含有的官能团的名称为 ,D的结构简式为 ;
(2)反应①—④中属于取代反应的有 ;
(3)反应①的化学反应方程式 ;反应②的化学反应方程式 ;
(4)某物质E为漂白剂(C14H10O4)的同分异构体,同时符合下列条件的E的同分异构体有 种;
①含有联苯结构单元(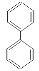 ),在一定条件下能发生银镜反应,且1molE最多可消耗4mol NaOH
),在一定条件下能发生银镜反应,且1molE最多可消耗4mol NaOH
②遇FeCl3溶液不显紫色, 且苯环上核磁共振氢谱有六个吸收峰。
且苯环上核磁共振氢谱有六个吸收峰。
(5)请写出以苯乙烯和乙烯为原料,合成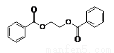 的流程,无机物任选,注明反应条件。示例如下:
的流程,无机物任选,注明反应条件。示例如下: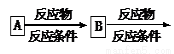
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com