
| A. | 晶胞是晶体结构中的基本结构单元 | |
| B. | 根据晶体的不同,晶胞可以是多种形状的几何体 | |
| C. | 晶胞一般都是平行六面体 | |
| D. | 晶胞都是正八面体 |
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应为吸热反应 | |
| B. | 该反应中,SO2为还原剂 | |
| C. | 1 mol H2S中含有的共价键的数目为3 mol | |
| D. | 常温下,H2S的还原性强于S的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
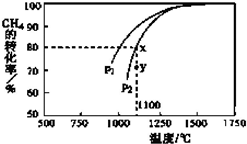 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 夏日的傍晚常常看到万丈霞光穿云而过美不胜收 | |
| B. | 受伤时,在流血的伤口上抹一点FeCl3可以止血 | |
| C. | “尿毒症”患者做血液透析治疗 | |
| D. | 三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | E(反应物)>E(生成物) | B. | E(反应物)<E(生成物) | C. | 反应放热 | D. | 反应吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种溶液中由水电离出来的c(H+)不相同 | |
| B. | 将两溶液等体积混合,则c(H+)>c(CH3COO-)═c(Cl-)>c(OH-) | |
| C. | 分别用蒸馏水稀释m倍和n倍,若两溶液pH仍相同,则m<n | |
| D. | 中和相同体积的两种酸溶液所需NaOH的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com