
【题目】根据要求书写化学方程式或离子方程式
(1)氢氟酸刻蚀玻璃的化学方程式为______________。
(2)利用铝热反应焊接钢轨的化学方程式为______________。
(3)铜鼎在潮湿的空气中被锈蚀生成铜绿的化学方程式为______________。
(4)铝粉与氢氧化钠溶液反应的离子方程式______________。
(5)氯化铝和过量氨水反应的离子方程式______________。
【答案】 SiO2+4HF=SiF4↑+2H2O 2Al+Fe2O3![]() 2Fe+Al2O3或者8Al+3Fe3O4
2Fe+Al2O3或者8Al+3Fe3O4![]() 9Fe+4Al2O3 2Cu+O2+CO2+H2O=Cu2(OH)2CO3 2Al+2OH-+6H2O=2[Al(OH)4]-+3H2 Al3++3NH3·H2O=Al(OH)3↓+3NH4+
9Fe+4Al2O3 2Cu+O2+CO2+H2O=Cu2(OH)2CO3 2Al+2OH-+6H2O=2[Al(OH)4]-+3H2 Al3++3NH3·H2O=Al(OH)3↓+3NH4+
【解析】(1)氢氟酸刻蚀玻璃的化学方程式为SiO2+4HF=SiF4↑+2H2O。(2)利用铝热反应焊接钢轨的化学方程式为2Al+Fe2O3![]() 2Fe+Al2O3或者8Al+3Fe3O4
2Fe+Al2O3或者8Al+3Fe3O4![]() 9Fe+4Al2O3。(3)铜鼎在潮湿的空气中被锈蚀生成铜绿的化学方程式为2Cu+O2+CO2+H2O=Cu2(OH)2CO3。(4)铝粉与氢氧化钠溶液反应的离子方程式为2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑。(5)氯化铝和过量氨水反应的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+。
9Fe+4Al2O3。(3)铜鼎在潮湿的空气中被锈蚀生成铜绿的化学方程式为2Cu+O2+CO2+H2O=Cu2(OH)2CO3。(4)铝粉与氢氧化钠溶液反应的离子方程式为2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑。(5)氯化铝和过量氨水反应的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=﹣Q1; 2H2(g)+O2(g)=2H2O(g)△H=﹣Q2;
H2O(g)=H2O(l)△H=﹣Q3
常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为( )
A.4Q1+0.5Q2
B.4Q1+Q2+10Q3
C.4Q1+2Q2
D.4Q1+0.5Q2+9Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质用途,用离子方程式解释不正确的是( )
A.氢氟酸刻蚀玻璃:SiO2+4HF=SiF4↑+2H2O
B.明矾用于净水:Al3++3H2O=Al(OH)3+3H+
C.纯碱去除油污:CO32﹣+H2O?HCO ![]() +OH﹣
+OH﹣
D.氯气制备“84”消毒液:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是

A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中只能有共价键
C. 由X、Y两种元素形成的化合物都是酸性氧化物
D. T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列条件下,两种气体的分子数一定相等的是
A. 同密度、同压强的N2和C2H4 B. 同温度、同体积的O2和N2
C. 同体积、同密度的C2H4和CO D. 同压强、同体积的O2和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对电化学问题进行了实验探究.
(1)Ⅰ.利用如图1装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生.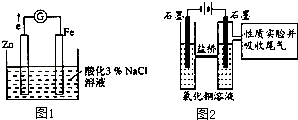
a.写出负极的电极反应式 .
b.某学生认为,铁电极可能参与反应,并对产物作出假设:
假设1:铁参与反应,被氧化生成Fe2+;
假设2:铁参与反应,被氧化生成Fe3+;
假设3: .
c.为了探究假设1、2,他采取如下操作:
①取0.01mol/L FeCl3溶液2mL于试管中,加入过量铁粉;
②取操作①试管的上层清夜加入2滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴K3[Fe(CN)6]溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴KSCN溶液,未见溶液变红;
据②、③、④现象得出的结论是 .
d.该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施 .
(2)Ⅱ.利用图2装置作电解50mL 0.5mol/L的CuCl2溶液实验.实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色;
B.电解一段时间以后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体.
a.分析实验记录A中试纸颜色变化,用离子方程式解释:
①;
② .
b.分析实验记录B中浅蓝色固体可能是(写化学式),试分析生成该物质的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.在NaClO溶液中通入过量SO2气体:ClO﹣+H2O+SO2═HClO+HSO ![]()
B.用稀氢碘酸溶液除去铁制品表面的铁锈:Fe2O3+6H+═2Fe3++3H2O
C.NaHCO3与少量的Ca(OH)2溶液反应:Ca2++2OH﹣+2HCO ![]() ═CaCO3↓+2H2O+CO
═CaCO3↓+2H2O+CO ![]()
D.10mL 0.5mol/L的明矾溶液与20mL 0.5mol/L Ba(OH)2溶液混合反应:3Ba2++6OH﹣+2Al3++3SO ![]() ═3BaSO4↓+2Al(OH)3↓
═3BaSO4↓+2Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴写出N2的电子式__________。下列能实现人工固氮的是__________。
A.闪电 B.在加压降温的条件下使空气中的氮气液化
C.根瘤 D.合成氨车间
⑵实验室通常用加热消石灰与氯化铵固体的方法来制取氨气。
写出该反应的化学方程式________________________________________。
实验室制取氨气的方法有多种,下面的装置和选用的试剂中错误的是__________。

⑶氨气可使湿润的红色石蕊试纸变蓝的原因(用化学用语表示)
____________________________________________________________
⑷用乙装置吸收一段时间氨后,再通入空气,同时将加热的铂丝插入乙 装置的锥形瓶内,锥形瓶中不可能生成的物质是:__________。
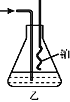
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
写出乙装置中氨催化氧化的化学方程式:_____________________。
⑸已知![]() ,常温常压下,在一密闭容器中将
,常温常压下,在一密闭容器中将![]() 和
和![]() 充分反应后,剩余气体的体积为__________
充分反应后,剩余气体的体积为__________ ![]() 。
。
⑹在标准状况下, ![]() 水中可溶解
水中可溶解![]() ,所得溶液的密度为
,所得溶液的密度为![]() ,则氨水的物质的量浓度为__________
,则氨水的物质的量浓度为__________ ![]() (保留一位小数)。
(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在其他条件不变时,改变某一条件对反应A2(g)+3B2(g)2AB3(g)的化学平衡状态的影响如图所示(T表示温度,n表示物质的量).下列判断正确的是( ) 
A.反应速率:a>b>c
B.达到平衡时A的转化率大小:b>a>c
C.若T2>T1 . 则正反应一定是吸热反应
D.达到平衡时,n( AB3)的大小:b>a>c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com