
常温下,下列溶液中各离子浓度关系表述正确的是( )
A.向NH4HSO4溶液中逐滴加入NaOH溶液至中性,溶液中c(Na+) > c(SO42-) > c(NH4+) > c(H+) = c(OH-)
B.等物质的量浓度的Na2CO3,NaHCO3混合溶液中c(Na+) > c(CO32-) >c(HCO3-) > c(OH-) > c(H+)
C.已知酸性HF > CH3COOH,pH相等的NaF与CH3COOK溶液中c(Na+)-c(F-) < c(K+)-c(CH3COO-)
D.在0.1mol/L 的Na2S溶液中 c(H+) + c(HS-) + c(H2S) = c(OH-)
A
【解析】
试题分析:A. NH4HSO4是强酸的酸式盐,若n(NH4HSO4)=n(NaOH)则得到的溶液中因为含有强酸弱碱盐溶液显酸性,所以要使溶液至中性,溶液中n(NH4HSO4)<n(NaOH),所以c(Na+) > c(SO42-) > c(NH4+) > c(H+) = c(OH-),正确;B. 等物质的量浓度的Na2CO3,NaHCO3混合溶液中由于CO32-的水解程度大于HCO3-,所以c(HCO3-) > c(CO32-) ,根据物料守恒可得c(Na+) > c(HCO3-) ; CO32-和HCO3-水解消耗水电离产生的H+,是溶液显碱性,所以c(OH-) > c(H+),故溶液中离子浓度关系是:c(Na+) > c(HCO3-)> c(CO32-) > c(OH-) > c(H+),错误;C.根据电荷守恒可知:C(H+) +C(Na+) =C(OH-) + C(F-) 移项后可得C(Na+) - C(F-)=C(OH-) -C(H+) 同理可得C(K+) - C(CH3COO-)=C(OH-) -C(H+) 又因为两种溶液PH相同,所以C(OH-) -C(H+) 相等,故C(Na+) - C(F-)= C(K+) - C(CH3COO-),错误;D.在0.1mol/L 的Na2S溶液中,根据质子守恒可得 c(H+) + c(HS-) + 2c(H2S) = c(OH-),错误。
考点:考查溶液中各离子浓度关系的知识。


科目:高中化学 来源:2014-2015学年山东安丘市期中考试高二化学模拟(B)卷(解析版) 题型:选择题
对已经达到化学平衡的下列反应: 2X(g)+Y(g)  2Z(g),减小压强时 ( )
2Z(g),减小压强时 ( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东临沂商城实验学校高一10月学情调研考试化学卷(解析版) 题型:填空题
(10分)在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命.下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g?mol﹣1) |
蔗糖 | 25.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.17 | 180 |
高锰酸钾 | 0.316 | 158 |
硝酸银 | 0.02 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是__________.
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)配制上述“鲜花保鲜剂”所需的仪器有:烧杯、玻璃棒、药匙、____________、____________、_______________.(在横线上填写所缺仪器的名称)
(3)在溶液配制过程中,下列操作对配制结果没有影响的是__________________.
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为__________mol/L.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东临沂商城实验学校高一10月学情调研考试化学卷(解析版) 题型:选择题
下列实验操作中,错误的是( )
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.把几滴FeCl3饱和溶液滴入25mL沸水中制备Fe(OH)3胶体
C.过滤可以除掉粗盐中可溶于水的杂质
D.碘易溶于有机溶剂,可用CCl4萃取碘水中的碘
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省江淮十校高三8月联考化学试卷(解析版) 题型:填空题
(8分)利用化学原理可以对工厂排放的废水、废渣等进行有效检测。某工厂对制铬工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸液中金属离子主要是Cr3+,其次是Fe3+, Fe2+, Al3+, Ca2+, Mg2+)
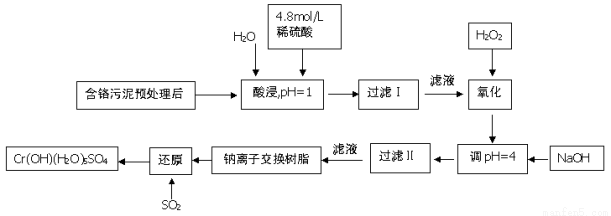
常温下部分阳离子的氢氧化物形成沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | — |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0(>9.0溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是 (至少一条)
(2)调pH=4.0是为了除去 (填Fe3+, Al3+, Ca2+, Mg2+)
(3)钠离子交换树脂的原理为Mn+ + n NaR → MRn +nNa+,被交换的杂质离子是 (填Fe3+, Al3+, Ca2+, Mg2+)
(4)试配平下列氧化还原反应方程式:
Na2Cr2O7 + SO2 + H2O = Cr(OH)(H2O)5SO4 + Na2SO4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省江淮十校高三8月联考化学试卷(解析版) 题型:选择题
主链上有四个碳原子的某种烷烃有两种同分异构体,与它含有相同碳原子数且主链也有四个碳原子的单烯烃的同分异构体有( )
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省江淮十校高三8月联考化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4L SO3中所含有分子数为NA
B.常温下,28 g 乙烯和丙烯的混合物中所含化学键一定为6NA
C.在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定为4NA
D.1 L 1mol/L NH4NO3溶液中氮原子数目小于2NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏高一上学期第一次月考化学试卷(解析版) 题型:选择题
已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是
A.16g B.32g C.64g /mol D.32g /mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市和平区高一上学期期中化学试卷(解析版) 题型:填空题
(16分)已知A和B两只试管的溶液中含有K+、Ag+、Mg2+、Cl-、NO3-、OH-六种离子,向A试管中滴加酚酞溶液呈红色。请回答下列问题:
(1)A试管的溶液中含有上述离子有__________;若向A溶液中加入铝片写出该化学反应的离子方程式____________________ ;
(2)向某试管中滴加稀盐酸产生白色沉淀,则该试管为____________(填A或B);
(3)若向B试管中加入合适的药品,过滤后可以得相应的金属和只含一种溶质的溶液,写出反应的离子方程式: ;
(4)若将试管A和试管B的溶液按一定的体积比混合过滤后,蒸干可得到—种纯净物,则混合过程中发生反应的离子方程式______________、___________;
(5)若向试管A的溶液中的阳离子组成的碳酸氢盐溶液中,分别滴加盐酸和少量Ba(OH)2,则反应的离子方程式分别为_______________、________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com