
| A����Ӧ�ﵽƽ��ʱ��A��B��C��Ũ�Ȳ��ٱ仯����Ӧֹͣ |
| B�������¶ȡ�����ѹǿ������A��Ũ�ȡ���СC��Ũ�Ȼ�ʹ�ô����ȶ�����ʹ��Ӧ���ʼӿ� |
| C�������㹻��ʱ���A��B������ȫת��ΪC |
| D��2sʱ����Aת����1.2mol |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��Fe2O3+3CO
| ||||
B��NH4NO3
| ||||
C��CaCO3
| ||||
D��4CuO
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��MnO4-��K+��Na+��SO42- |
| B��Na+��K+��HCO3-��Cl- |
| C��Mg2+��NH4+��Cl-��NO3- |
| D��Ba2+��K+��S2-��SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
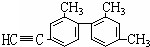 ��֪̼̼���������Ƽ���������ת���ṹ��ʽΪ��ͼ��ʾ����������˵������ȷ���ǣ�������
��֪̼̼���������Ƽ���������ת���ṹ��ʽΪ��ͼ��ʾ����������˵������ȷ���ǣ�������| A�������д���ͬһֱ���ϵ�̼ԭ�������7�� |
| B��������������12��̼ԭ�Ӵ���ͬһƽ���� |
| C�����������ϵ�һ�ȴ��ﹲ��3�� |
| D������������һ�ȴ��ﹲ��5�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1��6 | B��6��1 |
| C��2��3 | D��1��5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����A����B���롰B��A����������A��B��ԭ������ĺ�����ͬ |
| B��ʧ����Խ��Ļ�ԭ�����仹ԭ�Ծ�Խǿ |
| C��������ֻ�ܵõ��ӱ���ԭ���������� |
| D���������Ԫ�صĻ�����һ������ǿ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��250mL 0.4mol/L��ϡ������Һ |
| B��25mL 0.8mol/L��ϡ������Һ |
| C��100mL 1mol/L��ϡ������Һ |
| D��100mL 2mol/L��������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ�� | ��Ӧ�¶�/�� | Na2S2O3��Һ | ϡH2SO4 | H2O | ||
| V/mL | c/��mol?L-1�� | V/mL | c/��mol?L-1�� | V/mL | ||
| A | 10 | 15 | 0.2 | 10 | 0.2 | 15 |
| B | 10 | 15 | 0.4 | 5 | 0.4 | 20 |
| C | 35 | 15 | 0.2 | 10 | 0.2 | 15 |
| D | 35 | 15 | 0.4 | 5 | 0.4 | 20 |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������ұ��������ͨ���û���Ӧ�õ������� |
| B�����õ��ķ������ԴӺ�ˮ�л�õ�ˮ |
| C����ˮ����Ĺ����в�����������ԭ��Ӧ |
| D���Ա��ǡ���ˮ������Ϊԭ����������þ�Ĺ����в��漰�û���Ӧ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com