
| A. | 5 | B. | 6 | C. | 9 | D. | 10 |
分析 Na2CO3 •xH2O的物质的量为$\frac{14.3g}{(106+18x)g/mol}$,根据反应的化学方程式Na2CO3+2HCl=2NaCl+CO2↑+H2O可以计算出x的值.
解答 解:14.3g Na2CO3 •xH2O与20mL盐酸恰好完全反应生成正盐,反应的化学方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O,则
Na2CO3 •xH2O~2HCl
1 2
$\frac{14.3g}{(106+18x)g/mol}$ 0.2L×0.5mol/L
即2×$\frac{14.3g}{(106+18x)g/mol}$=0.2L×0.5mol/L,
解得x=10,
故选D.
点评 本题考查了有关物质的量浓度的计算、利用化学方程式的计算,题目难度中等,注意掌握物质的量与摩尔质量、物质的量浓度之间的转化关系.


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:选择题
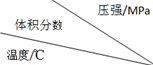 | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A. | 5个 | B. | 4个 | C. | 3个 | D. | 2个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用物质A表示的反应的平均速率为0.6mol•L-1•s-1 | |
| B. | 用物质B表示的反应的平均速率为0.6mol•L-1•s-1 | |
| C. | 2s时物质A的转化率为70% | |
| D. | 2s时物质B的物质的量为 1.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C=O | C═O | C-H |
| E/(kJ•mol-1) | 436 | 803 | 1070 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol | |
| B. | 一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3放热akJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-2akJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=-114.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
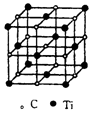 最近科学家们发现一种由钛原子和碳原子构成的气态团簇分子,如图所示.顶点和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是( )
最近科学家们发现一种由钛原子和碳原子构成的气态团簇分子,如图所示.顶点和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是( )| A. | TiC | B. | Ti6C7 | C. | Ti14C13 | D. | Ti13C14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸 | B. | 饱和硫酸镁溶液 | C. | 饱和氯化钡溶液 | D. | 饱和硫酸铵溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用钢瓶储存液氯或浓硫酸 | |
| B. | 硅胶可用作食品干燥剂 | |
| C. | pM2.5是指大气中直径接近2.5×10-6m的颗粒物,它分散在空气中形成胶体 | |
| D. | 神舟10号飞船所用太阳能电池板的材料是单晶硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
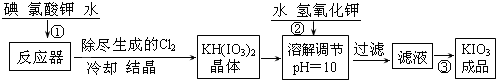
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com