



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 CO2��g��+H2��g�� �õ�������������
CO2��g��+H2��g�� �õ�������������| ʵ�� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ���ǹ�Ϊʹ�õ���������������H2O2�ͱ����ᷴӦ��ȡ�������ڹ��������г����в�����H2O2���ⶨ��Ʒ�й�������Ũ��c0���漰���з�Ӧ��
���ǹ�Ϊʹ�õ���������������H2O2�ͱ����ᷴӦ��ȡ�������ڹ��������г����в�����H2O2���ⶨ��Ʒ�й�������Ũ��c0���漰���з�Ӧ�� ��2H+ �T I2��2H2O
��2H+ �T I2��2H2O
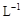 ��KMnO4����Һ�ζ����е�H2O2�����õ�KMnO4���Ϊb1 mL����Ӧ�٣��ζ�������KmnO4����������ᷴӦ������ȡb0 mL����Һ�����������KI����������ʹ��Һ�ữ����ʱ��������Ͳ�����H2O2���ܸ� KI��Ӧ���� I2����Ӧ�ںۣ͢�������Ũ��Ϊa2 mol��
��KMnO4����Һ�ζ����е�H2O2�����õ�KMnO4���Ϊb1 mL����Ӧ�٣��ζ�������KmnO4����������ᷴӦ������ȡb0 mL����Һ�����������KI����������ʹ��Һ�ữ����ʱ��������Ͳ�����H2O2���ܸ� KI��Ӧ���� I2����Ӧ�ںۣ͢�������Ũ��Ϊa2 mol��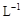 ��Na2S2O3����Һ�ζ����ɵ�I2������Na2S2O3��Һ���Ϊb2 mL��
��Na2S2O3����Һ�ζ����ɵ�I2������Na2S2O3��Һ���Ϊb2 mL���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��+2 �� | B��+3 �� | C��+4�� | D��+5�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��1/5 mol | B��2/5 mol |
| C��3/5mol | D��11/5 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0 | B��2 | C��1 | D��3 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com