
下列有关电解质溶液的说法正确的是( )
A.强电解质溶液的导电能力不一定比弱电解质溶液强
B.如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度也是醋酸的二倍
C.将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的二分之一
D.向稀氨水中加入氯化铵固体,溶液中平衡NH3+H2O NH3·H2O
NH3·H2O NH4++OH-正向移动
NH4++OH-正向移动
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年浙江省高二下期中化学试卷(解析版) 题型:简答题
某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:

沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是 。调pH步骤中加入的试剂最好是 (填化学式)。实验室进行过滤操作所用到的玻璃仪器有 、 、 。
(2)煮沸CuSO4溶液的原因是 。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式 。
(3)Fe3+发生水解反应Fe3++3H2O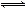 Fe(OH)3+3H+,该反应的平衡常数表达式为 。
Fe(OH)3+3H+,该反应的平衡常数表达式为 。
(4)称取所制备的CuCl样品0.250 0 g置于一定量的0.5 mol·L-1FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.100 0 mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00 mL。有关的化学反应为Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江余姚中学高一实验班下期中化学试卷(解析版) 题型:选择题
随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。 下列有关说法中,正确的是
A.N5+离子中含有36个电子 B.O2与O4属于同位素
C.C60是原子晶体 D.H2与H3属于同素异形体
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二下期中化学试卷(解析版) 题型:简答题
如下图所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深。请回答:
(1)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为__________。
(2)现用丙装置给铜件镀银,当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为__________。
(3)Fe(OH)3胶体的制备有严格的要求,小明想向FeCl3溶液中滴加NaOH溶液来制备Fe(OH)3胶体,结果很快就生成了红褐色的沉淀。他测得溶液的pH=5,则此时溶液中c(Fe3+)=__________mol/L。(己知Ksp[Fe(OH)3]=1×10-36)。
(4)若用甲烷燃料电池(电解质溶液为2L2mol/LKOH溶液)提供电源,持续通入甲烷,在标准状况下,消耗甲烷的体积VL。当消耗CH4的体积在44.8<V≤89.6时,此时电源中B极发生的电极反应为:__________。

查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二下期中化学试卷(解析版) 题型:选择题
一定质量的乙烯完全燃烧放出的热量为a KJ,将产生的CO2通入50ml 8mol/L NaOH溶液中,恰好完全吸收,则1mol乙烯完全燃烧放出的热量Q为( )
A.Q<5a KJ B.Q>10a kJ
C.5a kJ≤Q≤10a kJ D.无法确定
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二下期中化学试卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要应用。下列说法不正确的是( )
A.施肥时,草木灰(有效成份K2CO3)不能与NH4Cl混合使用
B.热的纯碱能去厨房油污是因为其水解呈碱性,可以使油脂水解成水溶性物质
C.在服用胃舒平(主要成分有氢氧化铝)期间可以食用醋、可乐等食品
D.使用含氟牙膏预防龋齿利用了沉淀转化的原理
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江大庆一中高二下第二次段考化学试卷(解析版) 题型:选择题
只用一种试剂,区别二甲苯、四氯化碳、庚烯、乙醇、碘化钠溶液、亚硫酸六种无色液体,应选用( )
A.双氧水 B.溴水 C.氢氧化钠溶液 D.硝酸银溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏中卫一中高一下第三次月考化学试卷(解析版) 题型:实验题
如右图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2 mL乙酸,充分摇匀。在右试管中加入5mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对右试管小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验。
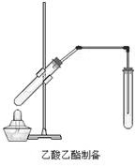
(1)写出左试管中主要反应的方程式:______________________________。
(2)加入浓硫酸的作用:_____________________________________。
(3)饱和Na2CO3的作用是: _____________________________________________。
(4)反应开始时用酒精灯对左试管小火加热的原因是______________________;(已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)
(5)分离右试管中所得乙酸乙酯和Na2CO3溶液的操作为(只填名称)______________,所需主要仪器为 。
(6)实验生成的乙酸乙酯,其密度比水 ,有 气味。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古平煤高中高一实验班下期中化学卷(解析版) 题型:选择题
碱性电池具有容量大,放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com