
下列含有极性键的非极性分子是
①CCl4 ②NH3 ③CH4 ④CO2 ⑤N2 ⑥H2O ⑦HF
A.②③④⑤ B.①③④⑤ C.①③④ D.以上均不对
科目:高中化学 来源:2016届河北省高三上学期期中测试化学试卷(解析版) 题型:选择题
Zn(OH)2是两性氢氧化物,和强酸反应时生成Zn2+,跟强碱反应时生成ZnO22-,现有三份等物质的量浓度、等体积的MgCl2、ZnCl2、AlCl3溶液(配制时均加入少量盐酸),现将一定浓度的NaOH溶液,分别滴入三种溶液中至过量,NaOH溶液的体积x(mL)与生成沉淀的物质的量y(mol)的关系如下图所示,则与MgCl2、ZnCl2、AlCl3三种溶液一一对应的正确图象是
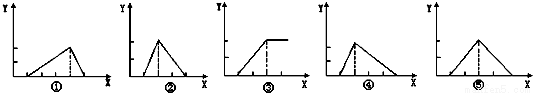
A.③②① B.③②④ C.③⑤① D.③⑤④
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期期中测试理综化学试卷(解析版) 题型:选择题
某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2- 中的若干种离子,离子浓度均为0.1 mol·L-1。某同学进行了如下实验,下列说法正确的是
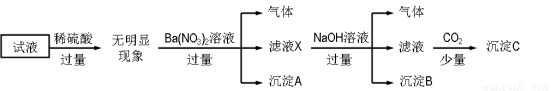
A.无法确定原试液中是否含有Al3+、Cl-
B.滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C.无法确定沉淀C的成分
D.原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二上学期期中测试化学试卷(解析版) 题型:填空题
铜是过渡元素。化合物中,铜常呈现+1价或+2价。
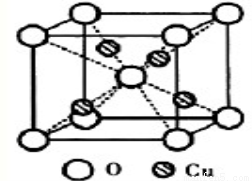
(1)铜原子的原子结构示意图: ;
(2)右图为某铜矿晶体结构单元,该铜矿的化学式为 。
(3)已知,铜的第一电离能为746kJ·mol-1,第二电离能为1958kJ·mol-1。请结合核外电子排布相关知识解释,铜第二电离能远远大于第一电离能的原因: 。
(4)对于CuX(X为卤素)而言,铜与X形成的化学键极性越强,对应的CuX的溶解度越大。据此可知,CuCl的溶解度比CuI的溶解度__________(填“更大”或“更小”);
(5)CO、NH3都能提供孤电子对与Cu+形成配合物。Cu+与NH3形成的配合物可表示为[Cu(NH3)n]+。该配合物中,Cu+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对。
①[Cu(NH3)n]+中n =______________________;
②[Cu(NH3)n]+中Cu+与n个氮原子构成的空间结构呈 型;
③[Cu(NH3)n]+溶液可用于吸收合成氨原料气中的CO,加热吸收CO后的溶液又将放出CO。加热分解放出CO的过程中,必须克服微粒间的作用力是 。
(6)+2价铜的氢氧化物难溶于水,但可溶于浓氨水形成配位数为4的配合物。写出氢氧化铜溶解于浓氨水的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省无锡市四校高二上学期期中测试化学试卷(解析版) 题型:实验题
某化学兴趣小组用如下图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。
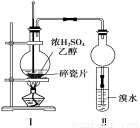
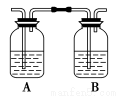
图1 图2
(1)写出该实验中生成乙烯的化学方程式 。
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确是 。
a.乙烯与溴水易发生取代反应
b.使溴水褪色的反应,未必是加成反应
c.使溴水褪色的物质,未必是乙烯
(3)乙同学经过细致观察后试管中另一实验现象后,证明反应中有乙烯生成,请简述这种这一实验现象 。
(4)丙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加上图2装置以除去乙醇蒸气和SO2,则A中的试剂是 ,B中的试剂为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省济宁市兖州区高一上学期期中测试化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A.稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑
B.硫酸铜溶液中加入铁粉反应:Cu2++Fe=Fe2++Cu
C.氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-=BaSO4↓
D.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省淄博市高二上学期期中测试化学试卷(解析版) 题型:选择题
燃烧a g乙醇(液态),生成二氧化碳气体和27g液态水,放出的热量为Q kJ,则表示乙醇燃烧热的热化学方程式书写正确的是
A.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1); △H = -Q kJ/mol
B.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1); △H = -Q/2 kJ/mol
C.1/2 C2H5OH(1)+3/2O2(g)=CO2(g)+3/2H2O(1); △H = -Q kJ/mol
D.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1); △H = -2Q kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com