
【题目】pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积的关系如图,下列说法正确的是

①若a<4,则A、B都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A.①④ B.②③ C.①③ D.②④
科目:高中化学 来源: 题型:
【题目】随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是( )
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗漏的电解液腐蚀其他物品
D.回收其中石墨电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入NH30.4mol,甲室中充入HCl、N2的混合气体,静止时隔板位置如图所示。已知甲、乙两室中气体的质量差为17.3g。

(1)甲室中HCl、N2的质量之比为_____ 。
(2)将隔板a去掉,当HCl与NH3充分反应生成NH4Cl固体后(仅发生此反应),隔板b将位于刻度“________”处(填数字,不考虑固体物质产生的压强),此时体系的平均相对分子质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 乙烯和苯都能发生氧化反应
B. 乙醇和乙酸都能发生中和反应
C. 淀粉和蛋白质的水解产物都是氨基酸
D. 葡萄糖和蔗糖都可发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,下列各组热化学方程式中,△H1>△H2的是
A.2H2 (g)+O2 (g)═2H2O (l) △H1 ;2H2 (g) +O2 (g)═2H2O (g) △H2
B.![]() △H1 ;C (s) +O2 (g) ═ CO2 (g) △H2
△H1 ;C (s) +O2 (g) ═ CO2 (g) △H2
C.S (g) + O2 (g) ═ SO2 (g) △H1 ;S (s)+O2(g)═SO2(g) △H2
D.H2 (g) +Cl2 (g)═2HCl (g) △H1 ;![]() △H2
△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3·H2O+H2O
B.实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O=4Fe3++4OH-
C.向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D.用酸化的高锰酸钾溶液氧化双氧水:2 MnO4-+6H++H2O2===2Mn2++3O2↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制0.50 mol/L NaCl溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器及用品有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、________、________以及等质量的两片滤纸。
(2)计算。配制该溶液需取NaCl晶体________ g。
(3)称量。①天平调平之后,应将天平的游码调至某个位置,请在图1中用一根竖线标出游码左边缘所处的位置。
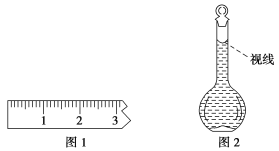
②称量过程中NaCl晶体应放于天平的________(填“左盘”或“右盘”)。
③称量完毕后,将药品倒入烧杯中。
(4)溶解、冷却。该步实验中需要使用玻璃棒,目的是_________________。
(5)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了_________________________。
(6)定容,摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、________、________。
(8)在配制过程中,某学生观察定容时液面情况如图2所示,所配溶液的浓度会________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝合金中含有合金元素镁、铜、硅,为了测定该合金中铝的含量,设计了如下实验,请回答有关问题:
(1)称取样品a g,称量时应该使用的主要仪器的名称是___________。
(2)将样品溶解于足量的稀盐酸,过滤。滤液中主要含有___________, 滤渣中含有____________,溶解、过滤用到的玻璃仪器是_________________。
(3)滤液中加过量NaOH 溶液、过滤。有关的离子方程式是______________。
(4)步骤(3)中的滤液中通入足量的CO2气体,可产生沉淀,过滤。有关的离子方程式是________________________________________________。
(5)步骤(4)过滤后的滤渣用蒸馏水洗涤数次,烘干并灼烧至恒重,冷却后称量,其质量是b g,原样品中铝的质量分数为____________________。
(6)若步骤(3)中加入NaOH的量不足,则实验结果偏______(填“高”“低”或“无影响”,下同);若步骤(5)中滤渣没有洗涤,则实验结果偏_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com