
【题目】(9分)认真观察下列装置,回答下列问题:
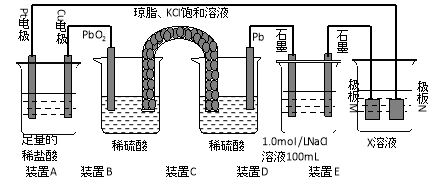
⑴装置B中PbO2上发生的电极反应方程式为 。
⑵装置A中总反应的离子方程式为 。
⑶若装置E中的目的是在Cu材料上镀银,则X为 ,极板N的材料为 。
若装置E的目的是验证金属的电化学防腐,则极板N的材料为__________________ 。
⑷当装置A中Cu电极质量改变6.4g时,装置D中产生的气体体积为 L(标准状况下)。
【答案】⑴PbO2+4H++SO2- 4+2e-=PbSO4+2H2O (2分)
⑵Cu+2H+![]() Cu2++H2↑(2分)
Cu2++H2↑(2分)
⑶AgNO3 Ag 惰性电极(或石墨等不溶性惰性材料)(各1分) ⑷3.92(2分)
【解析】(1)根据装置图可判断,BC是原电池,二氧化铅是正极,得到电子,电极反应式为PbO2+4H++SO2- 4+2e-=PbSO4+2H2O。
(2)A中铜电极和正极相连,是阳极,铜失去电子。阴极是Pt,溶液中的氢离子得到电子,所以总的反应式为Cu+2H+![]() Cu2++H2↑。
Cu2++H2↑。
(3)电镀时镀层金属作阳极,待镀金属作阴极,含有镀层金属离子的溶液作电镀液,所以X是硝酸银溶液。N是阳极,则N是银。由于N是阳极,所以如果装置E的目的是验证金属的电化学防腐,则极板N的材料应为惰性电极。
(4)当装置A中Cu电极质量改变6.4g时,转移电子是6.4g÷64g/mol×2=0.2mol。装置D中氯化钠是0.1mol,阴极是氢离子放电,氢气是0.1mol。阳极是氯离子放电,生成氯气,物质的量是0.05mol,所以阴极还生成氧气,物质的量是0.1mol÷4=0.025mol,
所以标准状况下的体积共计是(0.1mol+0.05mol+0.025mol)×22.4L/mol=3.92L.。


科目:高中化学 来源: 题型:
【题目】将下列四种铁的化合物溶于稀盐酸,滴加硫氰化钾溶液没有颜色变化,再加入氯水即呈红色的是 ( )
A.FeSB.Fe2O3C.FeCl3D.Fe2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将2mol气体A和1mol气体B充入容积为2L的恒容密闭容器中,发生如下反应:2A(g)+B(g)xC(g),2min时化学反应达到限度(温度仍为t℃),此时B还有 0.6mol,并测得C的浓度为0.6molL﹣1 . 请回答下列问题:
(1)判断该反应达到限度的标志是 a.容器中的压强保持不变
b.A的生成速率与B的消耗速率之比为2:1
c.容器内混合气体的密度保持不变
d.A的百分含量保持不变
e.B和C的物质的量浓度之比为1:x
(2)x= , 从反应开始到达到限度时,用B表示该反应的平均反应速率V(B)=;
(3)若保持温度不变,增大容器体积,则正反应速率(填“增大”、“减小”或“不变”)
(4)化学反应达到限度时,A的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某不纯的铁片可能含有Mg、Al、Cu等金属杂质,取这样的铁片5.6 g与足量的稀盐酸反应,得到0.2 g H2,则该铁片中
A. 一定不含杂质 B. 一定含金属铝
C. 一定含金属铜 D. 一定含有四种金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是( )
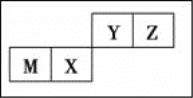
A. 原子半径Z<M
B. Y的最高价氧化物对应水化物的酸性比X的弱
C. X的最简单气态氢化物的热稳定性比Z的弱
D. Z位于元素周期表中第二周期、第ⅥA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于平衡膳食宝塔的认识中,正确的是( )
A. 塔底的食物最重要
B. 塔顶的食物最重要
C. 膳食宝塔所列食物摄入量对任何人都是最佳摄入量
D. 膳食宝塔所列食物摄入量是每人每日的建议摄入量,具体到不同的个体要根据自身的情况而调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )
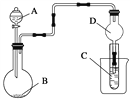
A. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来验证元素周期律. 用过氧化氢的水溶液和二氧化锰制备氧气,并将其通入到氢硫酸(H2S的水溶液)中.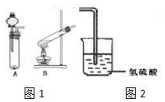
(1)过氧化氢的电子式:;
(2)从图1中选择氧气的制备装置 , 反应前需要的操作是:;
(3)该实验如何证明O的非金属性强于S(用化学方程式表示);
(4)你认为能证明Cl的非金属性强于S的是 a.S在常温下为固体而Cl2为气体 b.H2S不如HCl稳定
c.H2SO3的酸性弱于HClO3 d.S与H2化合不如Cl2与H2化合剧烈.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)。
2NH3(g)(正反应为放热反应)。
(1)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是_____________。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量____________,密度_____________。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_____________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com