
【题目】4p能级只填充一半电子的原子,其原子序数是
A. 15 B. 33 C. 35 D. 51
科目:高中化学 来源: 题型:
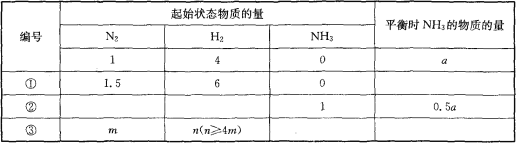
【题目】在一个盛有催化剂的容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2(g)+3H2(g)![]() 2NH3(g),已知加入1mol N2和4mol H2时,达到平衡后生成amol NH3,在相同温度、压强下,保持平衡时各组分的体积分数不变,对①~③的状态,填写表中空白。
2NH3(g),已知加入1mol N2和4mol H2时,达到平衡后生成amol NH3,在相同温度、压强下,保持平衡时各组分的体积分数不变,对①~③的状态,填写表中空白。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究重点。 已知利用FeO与Fe3O4循环制氢的相关反应如下:
反应I. H2O(g)+3FeO(s) ![]() Fe3O4 (s) + H2(g) △H=a kJ mo1-1;
Fe3O4 (s) + H2(g) △H=a kJ mo1-1;
反应II 2 Fe3O4(s) ![]() FeO (s) + O2(g) △H=b kJ mo1-1。
FeO (s) + O2(g) △H=b kJ mo1-1。
(1) 反应:2H2O(g)=2H2(g)+O2(g) △H =________(用含 a、b的代数式表示)kJ mo1-1。
(2)上述反应中a<0、b>0,从能源利用及成本的角度考虑,实现反应II可采用的方案是________。
(3)900℃时,在甲、乙两个体积均为2.0 L的密闭容器中分别投入0.60 mol FeO(s)并通入0.20 mol H2O(g),甲容器用 FeO细颗粒,乙容器用FeO粗颗粒。反应过程中H2的生成速率的变化如图1所示。
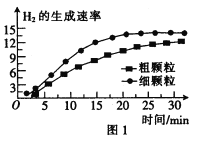
①用FeO细颗粒和FeO粗颗粒时,H2的生成速率不同的原因是__________。.
②用FeO细颗粒时H2O(g)的平衡转化率与用FeO粗颗粒时H2O(g)的平衡转化率的关系是___________(填“前者大”“前者小”或“相等”)。
(4)FeO的平衡转化率与温度的关系如图2所示。请在图3中画出1000℃、用FeO细颗粒时,H2O(g)转化率随时间的变化曲线(进行相应的标注)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.增加反应物浓度可以增加单位体积活化分子数目,但活化分子百分数保持不变
B.升高温度可以提高活化分子的百分数,从而提高反应速率
C.对于任何反应,压缩容器容积来增大压强,反应速率都加快
D.催化剂可以降低反应所需要的活化能,提高活化分子的百分数,从而提高反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有溶质的物质的量浓度均为0.1 mol/L的下列八种溶液①HCl ②H2SO4 ③CH3COOH ④Ba(OH)2 ⑤KOH ⑥NaF ⑦KCl ⑧NH4Cl 这些溶液的pH由小到大的顺序是
A.②①③⑧⑦⑥⑤④ B.②①③⑥⑦⑧⑤④
C.①②③⑧⑦⑥④⑤ D.②①⑧③⑦⑥④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.常温下,C(s)+CO2(g) = 2CO(g)不能自发进行,则该反应的△H>0
C.任何能使熵值增大的过程都能自发进行
D.反应物和生成物所具有的总焓决定了反应是否能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近来会宁县区的空气污染指数居高不下,雾霾天气严重,据分析霾中含有硫和氮的氧化物,如SO2、NOx等。
(1)NOx是汽车尾气中的主要污染物之一。
①NOx形成的酸雨被称为硝酸型酸雨,硝酸型酸雨中含有的主要离子有 ;浓硝酸发黄的原因(用化学方程式解释) 。
②汽车发动机工作时高温电火花会引发N2和O2反应,反应的化学方程式是 。
(2)因SO2的大量排放形成的酸雨被称为硫酸型酸雨,我国的酸雨主要是硫酸型酸雨。取硫酸型酸雨样品置于空气中,一段时间后发现该酸雨的酸性增强了,你认为原因是: (用化学方程式表示) 。
(3)为减少SO2的排放,常采取一些有效措施:
①在含硫煤中加入生石灰可以起到固硫的作用,燃烧过程中,硫元素转化成其最高价态的化合物,该化合物的化学式是 。
②下列物质中,可用于吸收烟气中的SO2的最佳溶液是 (填序号)。
a.Na2CO3b.H2SO4c.NaHSO3d.NH3·H2O
(4)取某空气样本用蒸馏水处理制成待测液,其中所含的离子及其浓度如下:
离子 | K+ | Na+ | NH4+ | H+ | SO42- | NO3- | Cl- |
浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | a | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据计算: a= mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com