
计算
(1) 在25℃时,Ksp(AgBr) = c(Ag+)·c(Br-)=1.0×10-12 ,若取0.188 g的AgBr(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Br-的物质的量浓度为 .
(2)在某温度下,重水(D2O)的离子积常数为1×10-12 . 若用PH一样的定义来规定PD值,则PD=-lg{C(D+)} ,1L溶有0.01mol的NaOD的D2O溶液,其PD= ;
(3) 在定容容器内加入一定量A(g),发生反应2A(g) ![]() B(g)+xC(g),在一定条件下从开始达到平衡后,压强增大了p %时,A的转化率也为p % ,则x的值为 .
B(g)+xC(g),在一定条件下从开始达到平衡后,压强增大了p %时,A的转化率也为p % ,则x的值为 .
(4)已知在25℃时,醋酸的Ka = 1.75×10-5 .在此温度下,0.2 moL/L醋酸与0.1 mol/L NaOH
溶液等体积混合后,溶液显 性, 此溶液中离子浓度大到小的顺序是 .
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
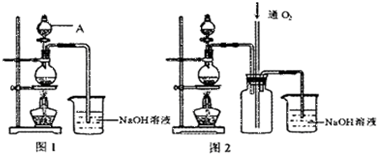
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | 实验编号 | T/K | 大理石规格 | c(HNO3) mol/L |
| (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格(粗、细)对该反应速率的影响;) |
① | 298 | 粗颗粒 | 2.00 |
| ② | ||||
| ③ | ||||
| ④ |
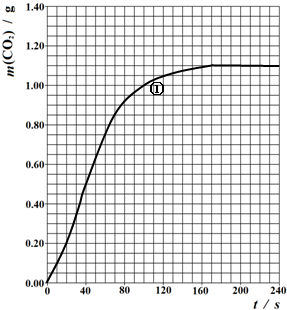
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com