
| A. | 在温度不变时,水溶液中c(H+)和c(0H-)不能同时增大 | |
| B. | pH=3的盐酸和pH=5的硫酸等体积混合,pH=4 | |
| C. | 中性溶液中必然有c(H+)=c(0H-)=1×10-7mol/L | |
| D. | 在0.1mol/L HCl溶液中加入适量的蒸馏水,溶液中各种离子的物质的量浓度均减小 |
分析 A.在温度不变时,水溶液中c(H+)×c(0H-)为定值;
B.酸溶液混合,先计算混合后溶液中氢离子的物质的量,再根据c=$\frac{n}{V}$计算氢离子的物质的量浓度,最后根据pH=-lgc(H+)计算出混合液的pH;
C.常温下,中性溶液中c(H+)=c(0H-)=1×10-7mol/L;
D.溶液中c(H+)×c(0H-)为定值.
解答 解:A.在温度不变时,水溶液中c(H+)×c(0H-)为定值,所以c(H+)和c(0H-)不能同时增大,故A正确;
B.pH=3的盐酸和pH=5的硫酸等体积混合后,设体积均为VL,混合液中氢离子的物质的量为:n(H+)=VL×10-3mol/L+VL×10-5mol/L≈10-3Vmol,
则混合溶液中氢离子浓度为:c(H+)=$\frac{1{0}^{-3}mol}{2VL}$=5×10-4mol/L,所以pH=-lg5×10-4=4-lg5=3.3,故B错误;
C.常温下,中性溶液中c(H+)=c(0H-)=1×10-7mol/L,温度不知道,所以c(H+)和c(0H-)不一定等于1×10-7mol/L,故C错误;
D.在0.1mol/L HCl溶液中加入适量的蒸馏水,c(H+)减小,由于溶液中c(H+)×c(0H-)为定值,所以c(0H-)增大,故D错误.
故选A.
点评 本题考查了混合液的pH的计算、影响水的电离平衡的因素,题目难度不大,注意掌握pH的表达式及计算方法,明确溶液酸碱性与溶液pH的关系为解答关键,试题有利于培养学生的化学计算能力.


科目:高中化学 来源: 题型:多选题
| A. | c(Na+)=2c(CO32-) | B. | c(H+)>c(OH-) | C. | c(CO32-)>c(HCO3-) | D. | c(CO32-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂经皂化反应后,生成高级脂肪酸钠,甘油和水形成混合液 | |
| B. | 加入食盐可以使肥皂析出,这一过程叫盐析 | |
| C. | 加入食盐搅拌后,静置一段时间,溶液分成上下两层,下层是高级脂肪酸钠 | |
| D. | 皂化反应后的混合溶液中加入食盐,可以通过过滤的方法分离提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用干燥洁净的玻璃棒蘸取NaClO溶液,滴到表面皿上的pH试纸上测pH | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上2%~5%的硼酸溶液 | |
| C. | 取金属钠时,要先用镊子夹取,再用小刀切下所需量,剩余钠不能放回原试剂瓶中 | |
| D. | 用NaOH标准溶液滴定盐酸,滴定管尖嘴部分若在滴定前无气泡,滴定终点时出现气泡,测定结果将偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
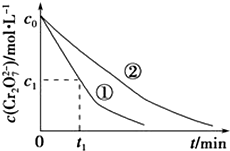 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 |
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 用等物质的量K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 | 反应进行相同时间后,若溶液中c(Cr2O72-)大于实验①中c(Cr2O72-),则假设一成立;若两溶液中的c(Cr2O72-)相同,则假设一不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com