
| A、-1 528 kJ?mol-1?? | B、-764 kJ?mol-1? | C、-382 kJ?mol-1?? | D、无法计算 |


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011 CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022| c(C2H5OH)?c3(H2O) |
| c2(CO2)?c6(H 2) |
| c(C2H5OH)?c3(H2O) |
| c2(CO2)?c6(H 2) |
| 温度/Kn(H2)/n(CO2)CO2转化率/% | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 煤直接燃烧的能量利用率较低,为提高其利用率,工业上将煤气化(转变成CO和H2)后再合成乙醇、二甲醚等多种能源.
煤直接燃烧的能量利用率较低,为提高其利用率,工业上将煤气化(转变成CO和H2)后再合成乙醇、二甲醚等多种能源.| 物质 | H2 | CO | CO2 | (CH3)2O | CH3OH | H2O |
| 体积分数 | 0.54 | 0.045 | 0.18 | 0.18 | 0.015 | 0.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO(g)+2H2(g)═CH3OH(g)△H>-90.5kJ?mol-1 | ||
| B、在甲醇燃料电池中,甲醇所在电极为正极 | ||
C、CH4(g)+
| ||
D、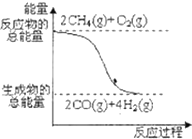 反应①中的能量变化如图所示 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com