
碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·x H2O]常用作塑料阻燃剂。
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和 。
(2)MgaAlb(OH)c(CO3)d·x H2O中a、b、c、d的代数关系式为 。
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390g样品与足量稀盐酸充分反应,生成CO20.560L(已换算成标准状况下)。②另取一定量样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如右图所示(样品在2700C时已完全失去结晶水,6000C以上残留固体为金属氧化物的混合物)。
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-): n(CO32-)(写出计算过程)。

科目:高中化学 来源: 题型:
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、NO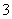 、CO
、CO 、X中的一种。
、X中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是________和________。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体,则X为________(填字母)。
A.Br- B.SO
C.CH3COO-  D.HCO
D.HCO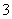
(3)将19.2 g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式__________________,若要将Cu完全溶解,至少加入H2SO4的物质的量是____________________。
Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式__________________,若要将Cu完全溶解,至少加入H2SO4的物质的量是____________________。
(4)E溶液与氢碘酸反应时可生成棕色物质,该反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
B.0.1mol丙烯酸中含有双键的数目为0.1NA
C.标准状况下,11.2L苯中含有分子的数目为0.5NA
D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A.氯水的颜色呈浅绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列过程没有发生化学反应的是
A、用活性炭去除冰箱中的异味
B、用热碱水清除炊具上残留的油污
C、用浸泡过高锰酸钾溶液的硅藻土保存水果
D、用含硅胶、铁粉的透气小袋与食品一起密封包装
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
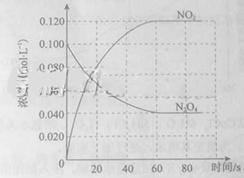
回答下列问题:
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 mol·L-1·s-1反应的平衡常数K1为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),判断理由是 。
②列式计算温度T是反应的平衡常数K2
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
| 实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
下列说法正确的是
A.实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率υ(N)=1.0×10-2mol/(L·min)
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡是,X的转化率为60%
D.实验④中,达到平衡时,b>0.060
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:________________________________________________________________________
与盐酸反应最剧烈,___________ _______与盐酸反应最慢。
_______与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:________________________________________________________________________
________________________________________________________________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。
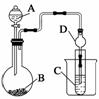
(3)仪器A的名称为________,干燥管D的作用是____________________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为________________________________________________________________________。
(5)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加________,观察到C中溶液的现象为________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com