
【题目】钒和镍及其化合物是重要的催化剂和合金材料.请回答:
(1)基态V原子的价层电子排布式为;其中能量最高的电子所占用能级的原子轨道有个伸展方向.
(2)VO2+与  可形成配合物.
可形成配合物.  中,三种非金属原子的第一电离能由大到小的顺序为(用元素符号表示);C原子的杂化轨道类型为 .
中,三种非金属原子的第一电离能由大到小的顺序为(用元素符号表示);C原子的杂化轨道类型为 .
(3)镍形成的Ni(NH3)62+、Ni(CN)42﹣中,NH3分子中N原子的价层电子对数目为 . 写出一种与CN﹣互为等电子体的分子的化学式: .
(4)La﹣Ni合金是重要的储氢材料,储氢后的晶胞如图所示.①合金中,1个La原子周围距离最近切相等的La原子数目为
②含有1molNi原子的合金中储存H2的物质的量为 . 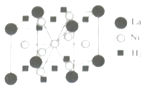
【答案】
(1)3d34s2;5
(2)O>C>H;sp3和sp2
(3)4;CO或者N2
(4)6;0.6mol
【解析】解:(1)V原子为23号元素,则价层电子排布式为:3d34s2;能量最高的为3d轨道,有5个伸展方向;故答案为:3d34s2;5;(2) 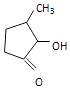 中,三种非金属原子分别为H、C、O,又同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族从上到下,元素的第一电离能逐渐减小,所以H、C、O三种非金属原子的第一电离能由大到小的顺序为O>C>H;又由
中,三种非金属原子分别为H、C、O,又同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族从上到下,元素的第一电离能逐渐减小,所以H、C、O三种非金属原子的第一电离能由大到小的顺序为O>C>H;又由  可以看出C原子分别形成单键和双键,则C原子的杂化轨道类型为sp3和sp2;故答案为:O>C>H;sp3和sp2;(3)NH3分子中N原子共用电子对数为3对,还有1对孤电子对,所以NH3分子中N原子的价层电子排布对数目位4对;CN﹣中含有2个原子,且其价电子数是10,与CN﹣互为等电子体的一种分子为CO、N2等,故答案为:4;CO或者N2;(4)①由晶胞可以看出1个La原子周围距离最近的La原子在顶点上,所以距离最近且相等的La原子数目为6,故答案为:6;②根据晶胞可以看出La原子个数为8×
可以看出C原子分别形成单键和双键,则C原子的杂化轨道类型为sp3和sp2;故答案为:O>C>H;sp3和sp2;(3)NH3分子中N原子共用电子对数为3对,还有1对孤电子对,所以NH3分子中N原子的价层电子排布对数目位4对;CN﹣中含有2个原子,且其价电子数是10,与CN﹣互为等电子体的一种分子为CO、N2等,故答案为:4;CO或者N2;(4)①由晶胞可以看出1个La原子周围距离最近的La原子在顶点上,所以距离最近且相等的La原子数目为6,故答案为:6;②根据晶胞可以看出La原子个数为8× ![]() =1,Ni原子个数为8×
=1,Ni原子个数为8× ![]() +1=5,所以合金化学式为LaNi5 , 并且一个晶胞储存2×
+1=5,所以合金化学式为LaNi5 , 并且一个晶胞储存2× ![]() +8×
+8× ![]() =3个氢气分子,则1molNi原子的合金中储存H2的物质的量为
=3个氢气分子,则1molNi原子的合金中储存H2的物质的量为 ![]() mol=0.6mol,故答案为:0.6mol.
mol=0.6mol,故答案为:0.6mol.
(1)V原子为23号元素,根据核外电子排布规律书写价层电子排布式;能量最高的为3d轨道,有5个伸展方向;(2)同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族从上到下,元素的第一电离能逐渐减小;根据结构可以看出C原子分别形成单键和双键,则C原子的杂化轨道类型为sp3和sp2;(3)根据氨气的电子式判断N原子的价层电子排布对数目;原子个数相等且价电子数相等的分子或离子为等电子体;(4)①根据晶胞可以看出1个La原子周围距离最近的La原子在顶点上;
②根据晶胞可以看出La原子个数为8× ![]() =1,Ni原子个数为8×
=1,Ni原子个数为8× ![]() +1=5,所以合金化学式为LaNi5 , 并且一个晶胞储存2×
+1=5,所以合金化学式为LaNi5 , 并且一个晶胞储存2× ![]() +8×
+8× ![]() =3个氢气分子,据此计算.
=3个氢气分子,据此计算.


科目:高中化学 来源: 题型:
【题目】随着卤素原子核电荷数的增加,下列递变规律正确的是
A. 单质的熔沸点逐渐降低B. 气态氢化物的稳定性逐渐降低
C. 卤素最高价含氧酸酸性逐渐增强D. 卤素单质的氧化性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有大量的Cl﹣、Br﹣、I﹣ , 若向1L该混合溶液中通入一定量的Cl2 , 溶液中Cl﹣、Br﹣、I﹣的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,原溶液中Cl﹣、Br﹣、I﹣的物质的量浓度之比为( )
Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
n(Cl﹣)/mol | 1.5 | 2.0 | 3.0 |
n(Br﹣)/mol | 3.0 | 2.8 | 1.8 |
n(I﹣)/mol | x(x>0) | 0 | 0 |
A.5:15:4
B.5:12:4
C.15:30:8
D.条件不足,无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由H、Na、Mg、S、O、Cl六种元素组成的物质,按要求,每小题各写出一个化学方程式
(1)是化合反应又是氧化还原反应的 .
(2)是分解反应又是氧化还原反应的 .
(3)是氧化还原反应又是置换反应的 .
(4)写出酸性氧化物与可溶性碱反应的化学方程式 .
(5)写出碱性氧化物与水反应的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com