
| A�� | ��NaAlO2��Һ��ͨ������CO2���а�ɫ����������˵��̼�������ǿ���������� | |
| B�� | �ò�˿պȡij��Һ������ɫ��Ӧ������ʻ�ɫ��˵����Һ�в�����K+ | |
| C�� | ��KI������Һ�е�����ˮ��������ͨ��SO2����ɫ��ȥ��˵��SO2����Ư���� | |
| D�� | ��ijFeCl2��Һ�У�����Na2O2��ĩ���ֺ��ɫ������˵��ԭFeCl2���������� |
���� A������ǿ���Ʊ�������ص��жϣ�
B���۲�����ӣ�Ӧ����ɫ�ܲ�����
C������������ⷢ��������ԭ��Ӧ��
D���������ƿ������������ӣ�
��� �⣺A��һ����˵��ǿ�����������η�Ӧ�Ʊ����ᣬ����NaAlO2��Һ��ͨ������CO2���а�ɫ����������˵��̼�������ǿ��������������A��ȷ��
B���۲�����ӣ�Ӧ����ɫ�ܲ���������ȥ�ƹ⣬��B����
C������������ⷢ��������ԭ��Ӧ������������ֻ�ԭ�ԣ���C����
D���������ƿ������������ӣ�����֤���Ƿ���ʣ���D����
��ѡA��
���� ���⿼���Ϊ�ۺϣ��漰Ԫ�ػ�����֪ʶ�����ʵļ����֪ʶ��Ϊ��Ƶ���㣬������ѧ���ķ���������ʵ�������Ŀ��飬ע�����ʵ��������ԺͿ����Ե����ۣ��ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
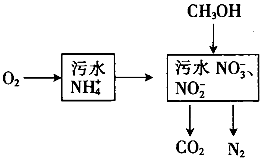 ����������ˮ�е�NH4+���������£�
����������ˮ�е�NH4+���������£��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��pH=4��ij��ϡ��10���������pH��5�������Ϊ���� | |
| B�� | ��ͬ�¶���ͬpH��CH3COONa��NaAlO2��NaHCO3������Һ�����ʵ���Ũ�ȴ�СΪ��c��NaAlO2����c��NaHCO3����c��CH3COONa�� | |
| C�� | 0.1 mol/L��NaA��Һ��0.1 mol/L��HA��Һ��������pH=4.75������Һ��c ��HA��+2c��H+��=2c��OH-��+c��A-�� | |
| D�� | ��NH4HSO4��Һ�еμ�NaOH��Һ�����ԣ����û��Һ��c��Na+����c��NH4+����c��SO42-����c��OH-��=c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �����£���100ml0.01mol/LHA��Һ����μ���0.02mol/LMOH��Һ����ͼ����ʾ���߱�ʾ�����Һ��pH�仯���������˵������ȷ���ǣ�������
�����£���100ml0.01mol/LHA��Һ����μ���0.02mol/LMOH��Һ����ͼ����ʾ���߱�ʾ�����Һ��pH�仯���������˵������ȷ���ǣ�������| A�� | HAΪһԪ���ᣬMOHΪһԪǿ�� | |
| B�� | ����MOH��Һ�����Ϊ50mlʱ����M+������A-�� | |
| C�� | N��ˮ�ĵ���̶ȴ���K��ˮ�ĵ���̶� | |
| D�� | K��ʱ������c��MOH��+��M+��=0.02mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pH=1����Һ�У�K+��Fe2+��NO${\;}_{3}^{-}$��Cl- | |
| B�� | 0.1 mol•L-1NaHCO3��Һ��Na+��Ba2+��NO${\;}_{3}^{-}$��OH- | |
| C�� | �μ�KSCN��Һ�Ժ�ɫ����Һ��NH${\;}_{4}^{+}$��K+��Cl-��I- | |
| D�� | ����������Һ�У�Cu2+��K+��SO${\;}_{4}^{2-}$��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Ӧ��Ϊ������ԭ��Ӧ | |
| B�� | ��Ӧ�١������������������� | |
| C�� | ��ͭ��ˮ��ͷ���Ӵ��ĸ���ˮ��������ʴ | |
| D�� | �����ڳ�ʪ�Ŀ�����ͨ������������ʴ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��25mL��ˮ�еμ�5��6��FeCl3������Һ���̳��ֺ��ɫ���� | |
| B�� | Na��Mg��AL�����������ˮ����ļ�������ǿ | |
| C�� | 1-������2����������ȥ����ĺ˴Ź�������ͼ��ͬ | |
| D�� | 2.3gNa��������ȫ��Ӧ��ת�Ƶĵ�����Ϊ0.1mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �������ȣ�ClNO�����л��ϳ��е���Ҫ�Լ�������NO��Cl2��ͨ�������·�Ӧ�õ�����ѧ����ʽΪ2NO��g��+Cl2��g��?2ClNO��g����
�������ȣ�ClNO�����л��ϳ��е���Ҫ�Լ�������NO��Cl2��ͨ�������·�Ӧ�õ�����ѧ����ʽΪ2NO��g��+Cl2��g��?2ClNO��g����| ��ѧ�� | N=O | Cl-Cl | Cl-N | N-O |
| ����/��kJ•mol-1�� | 630 | 243 | a | 607 |
| ��� | c��ClNO��/mol•L-1 | v/mol•L-1•s-1 |
| �� | 0.30 | 3.6��10-8 |
| �� | 0.60 | 1.44��10-8 |
| �� | 0.90 | 3.24��10-8 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com