
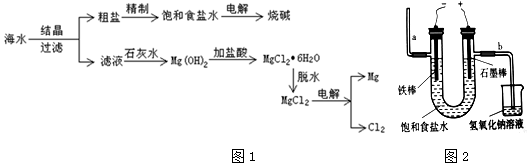
分析 海水蒸发溶剂得到粗盐和滤液,粗盐通过精制得到精盐,电解饱和食盐水得到氯气、氢气和氢氧化钠;滤液加石灰水反应生成氢氧化镁沉淀,氢氧化镁和酸反应生成氯化镁,制得氯化镁,电解熔融氯化镁得到金属镁和氯气,
(1)结合过滤装置选择需要的仪器,玻璃棒过滤中起到引流作用;
(2)镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,以此解答该题;
(3)电解饱和食盐水,与电源负极相连的Fe为电解池阴极,与电源正极连接的电极石墨为电解池阳极,溶液中氯离子在阳极失电子发生氧化反应生成氯气,溶液中氢离子在阴极得到电子发生还原反应生成氢气,电极附近水的电离平衡被破坏,氢氧根离子浓度增大溶液显碱性;
解答 解:(1)在实验室对海水进行过滤,所需要玻璃仪器为烧杯、漏斗和玻璃棒,玻璃棒在过滤操作中起到引流的作用,
故答案为:玻璃棒、引流;
(2)因用蒸发结晶的方法可以从海水中获得食盐,镁离子用氢氧根离子沉淀,加入过量的石灰乳可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,在进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以添加试剂的顺序为BCA或CBA,
故答案为:B C A或C BA;
(3)电解饱和食盐水,与电源负极相连的Fe为电解池阴极,与电源正极连接的电极石墨为电解池阳极,溶液中氯离子在阳极失电子发生氧化反应生成氯气,石墨电极上产生的气体为氯气,溶液中氢离子在阴极得到电子发生还原反应生成氢气,电极附近水的电离平衡被破坏,氢氧根离子浓度增大溶液显碱性,在铁棒周围的溶液里滴加酚酞,溶液变红色,
故答案为:氯气;红色.
点评 本题考查了物质的分离、提纯、电解原理应用,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握除杂的顺序以及相关离子反应,难度不大.


科目:高中化学 来源: 题型:解答题
 中和滴定的相关问题
中和滴定的相关问题| 滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在1~100 nm之间 | |
| B. | 溶液呈电中性,胶体带有电荷 | |
| C. | 溶液中分散质微粒能透过滤纸,胶体中分散质微粒不能透过滤纸 | |
| D. | 制备氢氧化铁胶体时,可以将饱和FeCl3溶液滴入沸水,然后长时间煮沸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 多吃肉,少吃蔬菜水果 | |
| B. | 合理摄入糖类.油脂等,注意膳食平衡 | |
| C. | 为防止变胖,炒菜时不放油 | |
| D. | 适量饮用矿泉水对身体健康有益 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2 L一氧化碳中含有的分子数等于0.5NA | |
| B. | 1mol FeCl3制得的氢氧化铁胶体中含胶粒数为NA | |
| C. | 32g臭氧所含电子数目为16NA | |
| D. | 0.5L 2mol/L盐酸中含有的HCl分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得溶液的物质的量浓度为1 mol.L-1 | |
| B. | 所得溶液中含有NA个HCl分子 | |
| C. | 36.5 g HCl气体占有的体积为22.4 L | |
| D. | 所得溶液的质量分数:w=$\frac{36.5c}{1000ρ}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合溶液的PH=7 | B. | 混合溶液中,C(H+)=$\sqrt{Kw}$mol•L-1 | ||
| C. | a=b | D. | 混合溶液中,C(H+)+C(B+)=C(OH-)+C(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
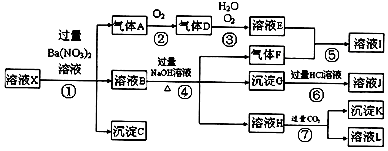
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com