
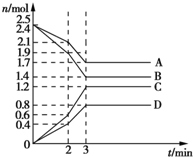
 在某容积为2L的密闭容器中,A、B、C、D四种气体物质发生可逆反应,其物质的量n(mol)随时间t(min)的变化如图所示.下列说法正确的是( )
在某容积为2L的密闭容器中,A、B、C、D四种气体物质发生可逆反应,其物质的量n(mol)随时间t(min)的变化如图所示.下列说法正确的是( )| A. | 前2min内,v(A)=0.2 mol/(L•min) | |
| B. | 在2min时,图象发生改变的原因只可能是增大压强 | |
| C. | 其他条件不变,3min时体系的压强不再发生变化 | |
| D. | 增加气体D的浓度,A的反应速率随之减小 |
分析 A.根据v=$\frac{\frac{△n}{V}}{△t}$计算出2min内的v(A);
B.增大压强和升高温度都能够增大反应速率;
C.3min时达到平衡状态,各组分的浓度不再变化,则体系的压强不再变化;
D.增大D的浓度,其它气体的反应速率都会加快.
解答 解:A.2min内,v(A)=$\frac{\frac{2.4mol-2.1mol}{2L}}{2min}$=0.075 mol/(L•min),故A错误;
B.在2min后反应速率加快,可能是增大压强或升高温度,故B错误;
C.根据图象可知,3min后各组分的浓度不再变化,说明此时达到平衡状态,若其他条件不变,则3min时体系的压强不再发生变化,故C正确;
D.A、B、C、D都是气体,增大D的浓度后,开始时其它物质的反应速率不变,之后A、B、D的反应速率都加快,故D错误;
故选C.
点评 本题考查了化学平衡的计算,题目难度中等,涉及反应速率计算、化学平衡及其影响、化学平衡状态的判断等知识,明确化学平衡及其影响为解答关键,试题培养了学生的分析能力及化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
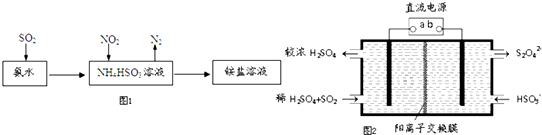 SO2和NOx都是大气污染物.
SO2和NOx都是大气污染物.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验序号 | 温度(℃) | 初始CCl4浓度(mol•L-1) | 初始H2浓度(mol•L-1) | CCl4的平衡转化率 |
| 1 | 110 | 1 | 1 | 50% |
| 2 | 100 | 1 | 1 | X |
| 3 | 110 | 0.8 | Y | 60% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验次数 | 待测氢氧化钠溶液体积(mL) | 标准盐酸体积(mL) | NaOH溶液浓度(mol/L) | ||
| 初读数 | 末读数 | 体积 | |||
| 1 | 20.00 | 0.50 | 20.70 | 20.20 | 0.1059 |
| 2 | 20.00 | 6.00 | 26.00 | 20.00 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平均反应速度:乙>甲 | B. | 平衡时nc(甲)>nc(乙) | ||
| C. | 平衡时C的转化率:甲>乙 | D. | 平衡时A的物质的量甲>乙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com