
化学在生产和日常生活中有重要的应用。下列说法错误的是
A、MgO、Al2O3的熔点很高,可制作耐高温材料,工业上也用其电解冶炼对应的金属
B、明矾水解形成胶体能吸附水中悬浮物,可用于水的净化
C、抗战70周年燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
D、铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀
科目:高中化学 来源:2016届山东师大附中高三上学期第二次模拟考试化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.碳元素的单质只存在金刚石和石墨两种同素异形体
B.Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg)
C.粗硅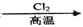 SiCl4
SiCl4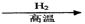 Si
Si
D.Mg(OH)2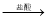 MgCl2(aq)
MgCl2(aq) Mg
Mg
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省温州十校联合体高二上学期期中测试化学试卷(解析版) 题型:选择题
将BaO2放入密闭的真空容器中,反应2BaO2(s) 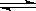 2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
A.平衡常数减小 B.BaO量不变
C.氧气浓度不变 D.平衡向右移动
查看答案和解析>>
科目:高中化学 来源:2016届湖南省澧县、桃源、益阳三校高三上学期联考化学试卷(解析版) 题型:填空题
氢气还原氧化铜反应不完全时,得到的是Cu、Cu2O、CuO的固体混合物。某化学兴趣小组为了探究某次氢气还原CuO实验最终所得的产物的组成,进行了如下实验:
①取一定质量的均匀的上述固体混合物A,将其分成两等份。
②取其中一份用足量的氢气还原,测得反应后固体的质量减小了3.20g
③另一份加入500mL的稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体2.24L。
请回答以下问题:
(1)A中,所含氧元素的物质的量为_________。
(2)A中,n(Cu)+n(Cu2O)=_______________。
(3)所用稀硝酸的物质的量浓度为_______________。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省淮安市高三上学期10月阶段测化学试卷(解析版) 题型:推断题
化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
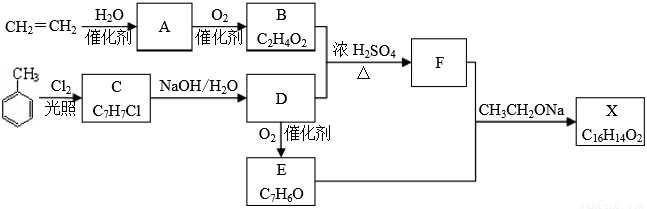
已知:RX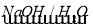 ROH;RCHO+CH3COOR′
ROH;RCHO+CH3COOR′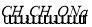 RCH=CHCOOR′
RCH=CHCOOR′
请回答:
(1) E中官能团的名称是 。
(2) B+D→F的化学方程式 。
(3)X的结构简式 。
(4)对于化合物X,下列说法正确的是 。
A、能发生水解反应 B、不与浓硝酸发生取代反应
C、能使Br2/CC14溶液褪色 D、能发生银镜反应
(5)下列化合物中属于F的同分异构体的是 。
A.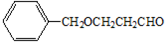 B.
B.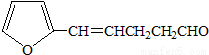
C.CH2=CHCH=CHCH=CHCH=CHCOOH D.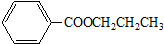
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川市高三上学期统练(三)化学试卷(解析版) 题型:选择题
已知:CO(g) + FeO(s) =Fe(s)+CO2(g) ΔH=-218kJ/mol,则14 g CO气体还原足量FeO固体得到Fe固体和CO2气体时放出的热量为
A.+218 kJ/mol B.-109 kJ/mol C. 218 kJ D. 109 kJ
查看答案和解析>>
科目:高中化学 来源:2016届辽宁师范大学附属中学高三上学期期中考试化学试卷(解析版) 题型:选择题
下列反应的离子方程式中正确的是
A.碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-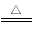 NH3↑+H2O
NH3↑+H2O
B.Ca(HCO3)2溶液中滴加少量NaOH溶液 Ca2++HCO3-+OH-=CaCO3↓+H2O
C.NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:
Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.向Fe(OH)2中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源:2016届江西上高第二中学高三12月月考理科综合化学试卷(解析版) 题型:填空题
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题。
I.对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体。2xCO+2NOx ==2xCO2+N2,当转移电子物质的量为0.8x mol时,该反应生成 LN2(标准状况下)。
II.一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,可以用来合成很多有机物如甲醇(CH3OH)、二甲醚(CH3OCH3)等,还可以作燃料。
(1)在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇: CO(g)+2H2(g) CH3OH(g) △H<0
CH3OH(g) △H<0
①该反应的平衡常数表达式为 。
②若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1 mol CO和3 mol H2
(2)已知:①CO(g)+2H2(g)CH3OH(g) △H=-90.7 kJ·mol-1
②2CH3OH(g)CH3OCH3(g)+H2O(g) △H=-23.5 kJ·mol-1
③CO(g)+H2O(g)CO2(g)+H2(g) △H=-41.2 kJ·mol-1
则3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)的△H=
(3)CO—空气燃料电池中使用的电解质是掺杂Y2O3的ZrO2晶体,它在高温下能传导O2—,该电池负极的电极反应式为 。
(4)甲醇也是新能源电池的燃料,但它对水质会造成一定的污染。有一种电化学法可消除这种污染。其原理是: 2滴甲醇,1mL 1.0mol·L—1硫酸,4mL 0.1mol·L—1硫酸钴
(CoSO4)混合溶液,插上两根惰性电极,通电后,将Co2+氧化成Co3+,
然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用图装置模拟上述过程:
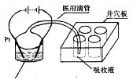
①检验电解时产生的CO2气体,井穴板穴孔内应盛放 溶液。
②写出净化甲醇的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2016届浙江宁波效实中学高三上学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.分子内共价键越强,分子越稳定,其熔、沸点也越高
B.共价化合物溶于水,分子内共价键一定被破坏
C.离子键的形成一定有电子的得与失
D.分子晶体中一定存在分子间作用力,不一定存在共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com