
| V-11.2n |
| 33.6n |
| V-11.2n |
| 33.6n |
| V |
| 22.4 |
| V-11.2n |
| 33.6n |
| V-11.2n |
| 33.6n |


 ������ϵ�д�
������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
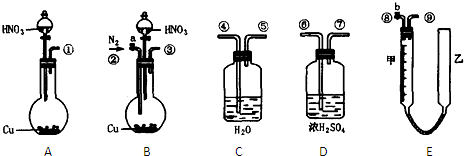
 ����������л�ѧʵ��ͼ������⣺
����������л�ѧʵ��ͼ������⣺| 233m1-142m2 |
| 233m1 |
| 233m1-142m2 |
| 233m1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ʡ��̶��ѧ2012�������ѧ�ڵ������¿���ѧ���� ���ͣ�058
| |||||||||||||||||||||||||||||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012�콭��ʡ������ѧ������ѧ�����п��Ի�ѧ�Ծ� ���ͣ�ʵ����
(12��) �ӻ��յĺ�ͭ���·�������ȡͭʱ����������������ַ������ش��й����⡣
�����ף�
�����ң�
��1�����������У����ϵ�ǰ��������ɫ��ѧ������Ƿ��� �������� ��
��2����������ͭ�ܽ�������ɫ��Һʱ������Ӧ�����ӷ���ʽΪ________________________��
����������ɫ��ѧҪ���ܽ�ͭ��������ͭʱ�����ɽ���������ֶ�μ��뵽ͭ����ϡ����Ļ�����У�����ʹͭ�ܽ���ȫ�����������������������ʵ���֮�����Ϊ�� �U ��
��3��Ϊ�����ԭ�ϵ�������,���һ������dz��ɫ��Һͨ������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ���Ȼ����ɵõ�һ�ֽᾧˮ����ľ��塣��þ���������м�⣺
����ȡa g�ľ��������ˮʵ�飬�����ˮ����Ϊ��a��1��26��g
�ڽ���ˮ��������������ˮ�����Һ��μ�1��00mol/L���Ȼ�����Һ�����μ�10��00mL��Һʱ������ǡ����ȫ��
ͨ�������֪�þ���Ļ�ѧʽ�� ��
��4���Ȼ���ͭ��CuCl������Ҫ�Ļ���ԭ�ϡ����ұ��涨�ϸ��CuCl��Ʒ����Ҫ����ָ��ΪCuCl��������������96.5% ����ҵ��������ͭ��ԭ�ϳ�ͨ�����з�Ӧ�Ʊ�CuCl ��
2CuSO4+ Na2SO3 + 2 NaCl + Na2CO3 =" 2" CuCl ��+ 3 Na2SO4 + CO2��
�ⶨCuCl��������ʱ��ȷ��ȡ���Ʊ���0.2500g CuCl��Ʒ����һ������0.5mol��L-1 FeCl3��Һ�У�����Ʒ��ȫ�ܽ��ˮ20mL����0.1000mol��L-1 Ce��SO4��2��Һ�ζ����յ㣬����24.60mL Ce��SO4��2��Һ���йط�Ӧ�����ӷ���ʽΪ��
Fe 3++CuCl=Fe 2++Cu2++Cl����Ce4+ + Fe 2+ = Fe 3+ + Ce3+
ͨ������˵��������Ʒ��CuCl�����������Ƿ���ϱ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�꽭��ʡ������ѧ�����п��Ի�ѧ�Ծ� ���ͣ�ʵ����
(12��) �ӻ��յĺ�ͭ���·�������ȡͭʱ����������������ַ������ش��й����⡣
�����ף�

�����ң�

��1�����������У����ϵ�ǰ��������ɫ��ѧ������Ƿ��� �������� ��
��2����������ͭ�ܽ�������ɫ��Һʱ������Ӧ�����ӷ���ʽΪ________________________��
����������ɫ��ѧҪ���ܽ�ͭ��������ͭʱ�����ɽ���������ֶ�μ��뵽ͭ����ϡ����Ļ�����У�����ʹͭ�ܽ���ȫ�����������������������ʵ���֮�����Ϊ�� �U ��
��3��Ϊ�����ԭ�ϵ�������,���һ������dz��ɫ��Һͨ������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ���Ȼ����ɵõ�һ�ֽᾧˮ����ľ��塣��þ���������м�⣺
����ȡa g�ľ��������ˮʵ�飬�����ˮ����Ϊ��a��1��26��g
�ڽ���ˮ��������������ˮ�����Һ��μ�1��00mol/L���Ȼ�����Һ�����μ�10��00mL��Һʱ������ǡ����ȫ��
ͨ�������֪�þ���Ļ�ѧʽ�� ��
��4���Ȼ���ͭ��CuCl������Ҫ�Ļ���ԭ�ϡ����ұ��涨�ϸ��CuCl��Ʒ����Ҫ����ָ��ΪCuCl��������������96.5% ����ҵ��������ͭ��ԭ�ϳ�ͨ�����з�Ӧ�Ʊ�CuCl ��
2CuSO4+ Na2SO3 + 2 NaCl + Na2CO3 = 2 CuCl ��+ 3 Na2SO4 + CO2��
�ⶨCuCl��������ʱ��ȷ��ȡ���Ʊ���0.2500g CuCl��Ʒ����һ������0.5mol��L-1 FeCl3 ��Һ�У�����Ʒ��ȫ�ܽ��ˮ20mL����0.1000mol��L-1 Ce��SO4��2��Һ�ζ����յ㣬����24.60mL Ce��SO4��2��Һ���йط�Ӧ�����ӷ���ʽΪ��
Fe 3++CuCl=Fe 2++Cu2++Cl�� ��Ce4+ + Fe 2+ = Fe 3+ + Ce3+
ͨ������˵��������Ʒ��CuCl�����������Ƿ���ϱ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com