
�о������������������̼��������ȴ�����Ⱦ��Ĵ���������Ҫ���塣
��1�������������ڰ�װ�Ĵ�ת��������ʹβ������Ҫ��Ⱦ��ת��Ϊ�����ʡ�����˵����˵�����º��������µķ�Ӧ;2NO��g��+2CO��g����N2��g��+2CO2��g����H=-746.5 kJ��mol-1�Ѵﵽ��ѧƽ����� ��
A����λʱ����������2moINO��ͬʱ���ĵ�2moICO
B��CO��CO2�����ʵ���Ũ����ȵ�״̬
C�������ܶȱ��ֲ����״̬
D������ƽ��Ħ���������ֲ����״̬
��2��NO2��SO2��Ͽɷ�����Ӧ��NO2��g��+SO2��g�� SO3��g��+NO��g����
SO3��g��+NO��g����
��һ������NO2��SO2���ھ��Ⱥ����ܱ������з���������Ӧ������Ӧ������ʱ��仯��������ͼ��ʾ����ͼ�������������Ӧ���ʣ���֪����˵����ȷ���� ������ĸ����

A����Ӧ��c��ﵽƽ��״̬
B����Ӧ��Ũ�ȣ�a��С��b��
C����Ӧ��������������������������
D����t1=��t2ʱ��SO2����������a��b�δ���b��c��
��3��CO��ʵ����������Ӧ�ã���Li2CO3��Na2CO3�����λ����������ʣ�COΪ����ȼ����������CO2�Ļ������Ϊ������ȼ�����Ƶ���650���¹�����ȼ�ϵ�ء�����йصĵ缫��Ӧʽ��
������Ӧʽ��2CO+2CO32-һ4e-��4CO2 ������Ӧʽ�� ��
��4������ȼ�ϵ�ؿ����������������ʡ���ͼ�����ü���ȼ�ϵ�ص��50 mL 2 mol��L-1���Ȼ�ͭ��Һ��װ��ʾ��ͼ��
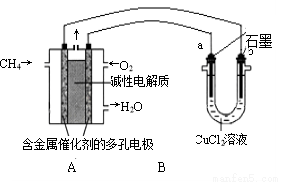
��ش𣺢ټ���ȼ�ϵ�صĸ�����Ӧʽ�� ��
�ڵ�A������0.15 mol����ʱ��B�� �����a����b��������__ __g��
 Ʒѧ˫�ž�ϵ�д�
Ʒѧ˫�ž�ϵ�д� Сѧ��ĩ���100��ϵ�д�
Сѧ��ĩ���100��ϵ�д� ��ĩ��ϰ���ϵ�д�
��ĩ��ϰ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�갲��ʡ�߶���ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij�¶��£����һ�����ܱ������н������¿��淴ӦX(g)+Y(g)  Z(g)+W(s) ����>0�����������У���ȷ����:
Z(g)+W(s) ����>0�����������У���ȷ����:
A����������W���淴Ӧ��������
B��������������ѹǿ����ʱ����Ӧ�ﵽƽ��
C�������¶ȣ�ƽ�������ƶ�
D���ı��������ִ���ƽ�⣬��ʱ������Ӧ��ƽ�ⳣ��Kֵһ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���㽭ʡ����ʮУ�������һ��ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��NA��ʾ�����ӵ�������������������ȷ����
A�����³�ѹ�£�11.2L����������ԭ����ΪNA
B��1.8g��NH4+�����к��еĵ�����Ϊ11NA
C�����³�ѹ�£�48gO3���е���ԭ����Ϊ3NA
D��5.6g������������ϡ���ᷴӦʱʧȥ�ĵ�����Ϊ0.3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ��ء���Դ��������У������ѧ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
���и���ѧ���������ȷ����
A��Naԭ�ӽṹʾ��ͼ��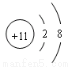
B������Ľṹ��ʽ��CH3CH3
C��HClO�Ľṹʽ��H��Cl��O
D��CH4���ӵı���ģ�ͣ�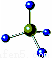
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����������и�����ѧ��ͳ����������ѧ�Ծ��������棩 ���ͣ������
��Ԫ�����γɶ��ֶ����Ļ����
��1����֪N2O4 (g) 2NO2 (g) ��H��+57.20 kJ/mol ��t��ʱ����һ������NO2��N2O4,����һ������Ϊ2L�ĺ����ܱ������У�Ũ����ʱ��仯��ϵ���±���ʾ��
2NO2 (g) ��H��+57.20 kJ/mol ��t��ʱ����һ������NO2��N2O4,����һ������Ϊ2L�ĺ����ܱ������У�Ũ����ʱ��仯��ϵ���±���ʾ��
ʱ��/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
c(Y)/(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
��c(X)���� ���ѧʽ����Ũ�ȣ��÷�Ӧ��ƽ�ⳣ��K= ��
��20 minʱ�ı�������� �����´ﵽƽ��ʱ��N2O4��ת���ʽ� ����ѡ��ǰ��ĸ����
a������ b����С c������ d�����ж�
��t��ʱ,�����������˵���÷�Ӧ����ƽ��״̬���� ��
A�����������ܶȱ��ֲ��� B������������ɫ���ٱ仯
C��������������ѹǿ���ֲ��� D��N2O4��NO2�����ʵ�����Ϊ10:3
������Ӧ��t����У�ijʱ�̲��n(NO2)=0.6 mol��n(N2O4)=1.2mol�����ʱv(��) v���棩���� ��>�� ����<����=������
��2����֪2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l) ��H= -1225 kJ/mol
��ѧ�� | N-H | N-N | N��N | O-H |
���ܣ�kJ/mol�� | 390 | 190 | 946 | 460 |
��ʹ1 mol N2O4 (l)��ȫ�ֽ����Ӧ��ԭ��ʱ��Ҫ���յ������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʦ����ѧ������ѧ������ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�ڸ��������£����м��ߵ������ڻ�ѧ��Ӧ�м����ܱ���ȫ���ĵ���
A��8.7g����������50mL8mol��L��1Ũ���Ṳ����ȡ����
B��19.2gͭ��100mL12mol��L��1�����ᷴӦ
C�������£���5.4g��ƬͶ��20mL18mol��L��1��������
D����������Cu����50mL18mol��L��1H2SO4��Һ�м���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ�ϲ��и�����ѧ�ڵ����ο��Ի�ѧ�Ծ��������棩 ���ͣ������
��þ����Ҫ�ɷ���MgO(ռ35��)������CaO��MnO��Fe2O3��FeO��Al2O3��SiO2�����ʡ�����þ������ȡMgSO4��7H2O���������£�
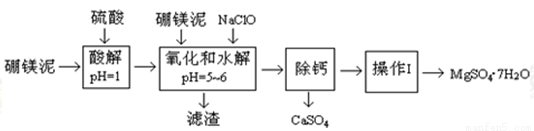
��֪��NaClO��Mn2+��Ӧ����MnO2������
������ | Fe��OH��3 | Al��OH��3 | Fe��OH��2 |
��ʼ����pH | 2.3 | 4.0 | 7.6 |
��ȫ����pH | 4.1 | 5.2 | 9.6 |
��������ش�ڣ�1������5���⣺
��1�����������У����ӿ����ʱ�Ļ�ѧ��Ӧ���ʣ���������ֿ��еĴ�ʩ�� �� ��
��2�������NaClO����Mn2+��Ӧ��Mn2+ + ClO�� + H2O �� MnO2�� + 2H+ + Cl��������һ������Ҳ�ᱻNaClO������������ˮ�⣬�÷�Ӧ�����ӷ���ʽΪ ��
��3����������Ҫ�ɷݳ�����Fe��OH��3��Al��OH��3 ��MnO2�⣬���� ��
��4����֪MgSO4��CaSO4���ܽ�����±���
�¶ȣ��棩 | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
�����ơ��ǽ�MgSO4��CaSO4�����Һ�е�CaSO4��ȥ�������ϱ����ݣ���Ҫ˵����������������Ũ���� ��������I���ǽ���Һ��������Ũ������ȴ�ᾧ�� __________ ����õ���MgSO4��7H2O��
��5��ʵ�����ṩ����þ�100 g���õ���MgSO4��7H2OΪ172.2 g������MgSO4��7H2O�IJ���Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ�������ĴΣ�12�£��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���б�ʾ��Ӧ��ѧ��Ӧ�����ӷ���ʽ��ȷ����
A��Fe2O3����HI��Һ�У�Fe2O3 + 6H+ ��2Fe3++ 3H2O
B��̼���Ƶ�ˮ��������
CO32��+ 2H2O H2CO3 + 2OH��
H2CO3 + 2OH��
C����������Һ�еμӹ���Ũ��ˮ��Al3����4NH3��H2O===AlO ��4NH4����2H2O
��4NH4����2H2O
D���ù���������ữ�����ҽ���Һ����ȡ�⣺2I��+H2O2+2H+ =I2 +2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������������һ��ѧ������ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��FECl3��Һ��ʴӡˢ��·���ϵ�ͭ��������Һ�м������ۡ��Լ������۳�ַ�Ӧ�����Һ������������
A��������ʣ�࣬����Һ��һ����FE3��
B�����й�����ڣ�����Һ��һ����FE2��
C������Һ����Cu2������һ��û�й�������
D������Һ����FE2������һ����Cu����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com