钨(
74W)是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,在自然界主要以钨(+6价)酸盐的形式存在.黑钨矿是冶炼钨的主要矿石之一.它的主要成分是铁和锰的钨酸盐(FeWO
4和MnWO
4).
黑钨矿传统冶炼工艺的第一阶段是碱熔法(工业流程如图所示):
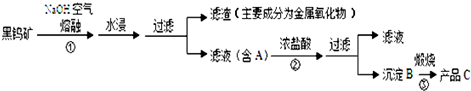
已知:①钨酸(H
2WO
4)酸性很弱,难溶于水.②在冶炼过程中钨元素的化合价保持不变.
(1)
74W在周期表的位置是第
周期.
(2)操作①中MnWO
4转化为MnO
2的化学方程式
.
(3)实验室检验滤渣中含有Fe
2O
3的方法是
.
(4)上述流程中B、C都是钨的化合物,则B为
,B→C的反应类型是
.
(5)钨冶炼工艺的第二阶段是用氢气、铝等还原剂把产品C还原为金属钨.对钨的纯度要求不高时,可用铝作还原剂.写出用铝还原产品C制取金属钨的化学方程式
;实验室引发该反应的操作方法是
.
(6)常温下,黑钨矿中FeWO
4和MnWO
4的溶度积常数分别为:Ksp(FeWO
4)=2.5×10
-12;Ksp(MnWO
4)=7.5×10
-16;欲将体积为1L含MnWO
4物质的量为0.6mol悬浊液全部转化为FeWO
4悬浊液,理论上可往MnWO
4悬浊液加入等体积一定浓度的FeCl
2溶液完成上述转化;请计算所加入FeCl
2溶液浓度为
mol/L,所以实际生产过程
(填“能”或“不能”)通过加入FeCl
2溶液的方法实现上述转化.(注:混合后溶液体积变化可忽略.)




 的烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,绘制了如图所示的球棍模型.下列说法中错误的是( )
的烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,绘制了如图所示的球棍模型.下列说法中错误的是( )


 2014年10月初,雾霾天气多次肆虐河北、天津、北京等地区.其中,燃煤和汽车尾气是造成空气污染的原因之一.
2014年10月初,雾霾天气多次肆虐河北、天津、北京等地区.其中,燃煤和汽车尾气是造成空气污染的原因之一.