
| A. | 铝片与稀H2SO4反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与CO2反应 | D. | NaOH与HCl反应 |
分析 属于氧化还原反应说明该反应中有电子转移,其特征是有元素化合价升降,属于放热反应说明该反应中反应物总能量大于生成物总能量,据此分析解答.
解答 解:A.铝片与稀H2SO4反应,该反应中Al、H元素化合价发生变化,属于氧化还原反应,且该反应还是放热反应,故A正确;
B.Ba(OH)2•8H2O与NH4Cl 的反应属于吸热反应,且该反应中没有元素化合价变化,不属于氧化还原反应,故B错误;
C.C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO,该反应是吸热反应,故C错误;
D.NaOH与HCl反应,该反应中没有元素化合价变化,不属于氧化还原反应,故D错误;
故选A.
点评 本题考查了氧化还原反应、放热反应的判断,根据元素化合价是否变化确定是否是氧化还原反应,再结合反应热分析解答,常见的放热反应有:中和反应、所有的燃烧反应、大多数化合反应等,题目难度不大.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 煤、石油、天然气均为化石燃料,它们属于可再生资源 | |
| B. | 生物质能来源于植物及其加工产品所贮存的能量 | |
| C. | 氢气的燃烧产物是水,不会污染环境,是理想的清洁燃料 | |
| D. | 大自然利用太阳能最成功的是植物的光合作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
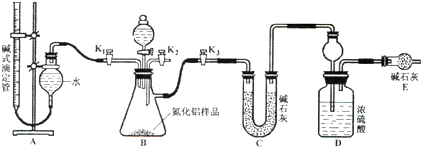
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制氧气时,用Na2O2或H2O2作反应物选择相同的气体发生装置 | |
| B. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化和干燥气体 | |
| C. | 制氢气时,用浓硫酸与锌反应比用稀硫酸快 | |
| D. | 制二氧化氮时,用水或NaOH溶液吸收尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃由水电离的c(H+)=10-12mol/L 的溶液:Fe3+ Cl- NO3- K+ | |
| B. | 使酚酞变红的溶液:Na+ Cl- SO42-AlO2- | |
| C. | 某无色溶液:HCO3- NO3- Al3+ Ba2+ | |
| D. | 25℃时,pH=1的溶液:Ba2+ NO3- K+ I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有大量SO32-溶液中:Na+、NH4+、SO42-、NO3- | |
| B. | 强碱性溶液中:NH4+、Ca2+、NO3-、Cl- | |
| C. | 强酸性溶液中:Cu2+、Mg2+、HCO3-、SO42- | |
| D. | 有大量Ba2+溶液中:K+、Ca2+、CO32-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A+B═C+D | B. | 2A+B═2C+D | C. | A+B═2C+D | D. | 2A+B═C+2D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com