
| A. | 升高温度可以提高CO的转化率 | |
| B. | 加入催化剂能提高CO的转化率 | |
| C. | 缩小反应器容积可以使平衡正向移动 | |
| D. | 再充入适量H2,该反应平衡常数的数值会增大 |
科目:高中化学 来源: 题型:解答题
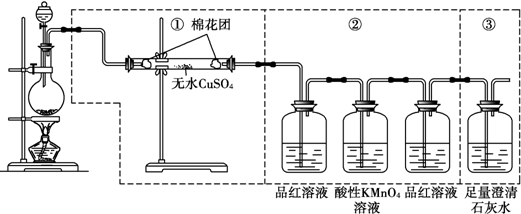
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
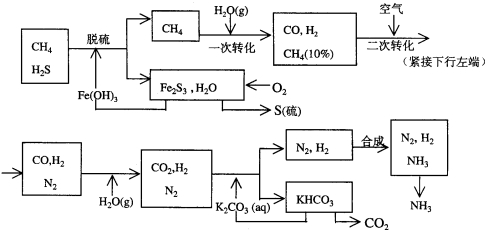
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变外界条件不能改变化学反应的限度 | |
| B. | 当某反应在一定条件下达到反应限度时即达到化学平衡状态 | |
| C. | 浓度、压强、催化剂、温度等均能改变活化分子的百分数 | |
| D. | 能自发进行的反应其速率都很大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
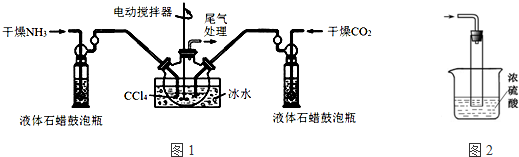
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
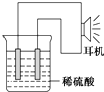 乙同学利用生活中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池.请填写下列空白:
乙同学利用生活中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
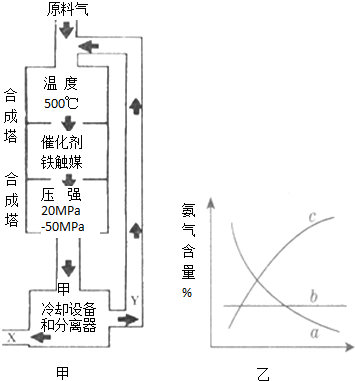 利用所学化学知识解答问题:
利用所学化学知识解答问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com