
四种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是 ( )
A.与W相邻的同主族元素可制成重要的半导体材料
B.X单质不可能置换出W单质
C.元素原子半径从大到小的顺序是X、Y、Z
D.W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是HZO4
【知识点】元素周期表和元素周期律
【答案解析】B 解析:根据题意,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,则X是Mg元素,W是C元素,Z是Cl元素,其原子的最外层电子数之和为19,Y是S元素;A、与W相邻的同主族元素是Si,可制成重要的半导体材料,故A正确;B、Mg可以与CO2反应生成C和MgO,故B错误;C、元素原子半径从大到小的顺序是Mg、S、Cl,故C正确;D、非金属性越强,最高价含氧酸酸性越强,W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是HClO4,故D正确。
故答案选B
【思路点拨】本题考查元素的推断和元素周期律,半径的比较、最高价含氧酸的酸性等知识,关键是推断元素,难度中等。


科目:高中化学 来源: 题型:
下列说法正确的是 ( )
①正常雨水的PH为7.0,酸雨的PH小于7.0。
②严格执行机动车尾气排放标准有利于防止大气污染
③使用二氧化硫和某些含硫化合物进行增白的食品会对人体健康产生损害
④使用氯气对自来水消毒过程中,生成的有机氯化物可能对人体有害
⑤食品厂产生的含丰富氮、磷营养素的废水可长期排向水库养鱼
A、①②③ B、①④⑤ C、②③④ D、③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的数据
B.升高温度或加入催化剂,可以改变化学反应的反应热
C.根据能量守恒定律,反应物的总能量一定等于生成物的总能量
D.物质发生化学变化一定伴随着能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
用50 mL 0.55 mol/L盐酸与50 mL 0.50 mol/L NaOH溶液进行中和热测定的实验,测量结果偏高的原因可能是( )
A.实验装置保温、隔热效果差
B.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
C.量取NaOH溶液的体积时仰视读数
D.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温下,容积为2L的密闭容器中加人1mol N2和X mol H2,发生如下反应:
N2(g)+3H2(g) 2NH3(g),50秒后达到平衡,测得反应放出的热量为18.4 kJ,
2NH3(g),50秒后达到平衡,测得反应放出的热量为18.4 kJ,
c(NH3)=0.2mol/L,总物质的量为3.6 mol.
(1)该反应的ΔH= kJ·mol-1
(2)该条件下此反应的化学平衡常数的表达式K=________________温度升高,则K值________。(填“变大”、“变小”或“不变”).
(3)起始时充入的H2的物质的量X为_____,从反应开始到平衡,用H2的浓度变化表示的反应速率为:_____________。
(4)若起始时加入N2 、H2 、NH3的物质的量分别为a、b、c,达到平衡时各组分的物质的量与上述平衡相同。
①若维持反应向正方向进行,则起始时c的取值范围是________________(3分).
②若c=2 mol,在相同条件下达到平衡时,该反应吸收的热量为____________ kJ.
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=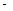 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H=+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=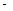 566.0 kJ·mol-1
566.0 kJ·mol-1
 反应CO2(g)+CH4(g)
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=________________
2CO(g)+2H2(g) 的△H=________________
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_____________________
②为了提高该反应中CH4的转化率,可以采取的措施是________________________
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为___________________________
(3)Li2O、Na2O、MgO均能吸收CO2。①如果寻找吸收CO2的其他物质,下列建议合理的是______
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是___________________________
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:
高温电解技术能高效实现(3)中反应A,工作原理示意图如下:
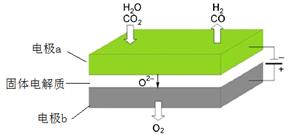
CO2在电极a放电的反应式是_____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子能在指定环境中大量共存的是( )
A.在c(HCO3-)=0.1 mol·L-1的溶液中:NH4+、AlO2-、Cl-、NO3-
B.在由水电离出的c(H+)=1×10-12 mol·L-1的溶液中:Fe2+、ClO-、Na+、SO42-
C.在加入铝粉产生H2的溶液中:SO42-、NO3-、Na+、NH4+
D.在使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程:
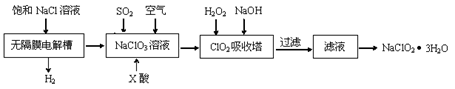
已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用。
②ClO2气体在中性和碱性溶液中不能稳定存在。
(1)在无隔膜电解槽中持续电解一段时间后,生成氢气和NaClO3,请写出阳极的电极反应方程式 。
(2)反应生成ClO2气体需要X酸酸化,X酸可以为 。
A.盐酸 B.稀硫酸 C.硝酸 D.H2C2O4溶液
(3)吸收塔内的温度不能过高的原因为 。
(4)ClO2被S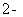 还原为ClO
还原为ClO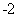 、Cl
、Cl 转化率与pH关系如图。
转化率与pH关系如图。
写出pH≤2时ClO2与S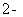 反应的离子方程式: 。
反应的离子方程式: 。

(5)ClO2对污水中Fe2+、Mn2+、S2-和CN 等有明显的去除效果。某工厂污水中含CN
等有明显的去除效果。某工厂污水中含CN amg/L,现用ClO2将CN
amg/L,现用ClO2将CN 氧化,生成了两种无毒无害的气体,其离子反应方程式为_______________________;处理100 m3这种污水,至少需要ClO2 _____________ mol。
氧化,生成了两种无毒无害的气体,其离子反应方程式为_______________________;处理100 m3这种污水,至少需要ClO2 _____________ mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com