
| 元素名称及符号 | 钠Na | 镁Mg | 硫S | 氯Cl | 溴Br | |
| 最外层电子数 | 1 | 2 | 6 | 7 | 7 | |
| 常 见 化合价 |
最高正价 | +1 | +2 | +6 | +7 | +7 |
| 负价 | 无 | 无 | -2 | -1 | -1 | |


科目:高中化学 来源: 题型:
A.每一横行元素原子的电子层数都不相同
B.每一纵行元素原子的最外层电子数都不相同
C.中间纵行元素很不容易与其他元素化合
D.左边纵行的元素的金属性很强
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)将化学知识系统化,有助于对化学问题的进一步认识和理解。
资料1:化学反应的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
资料2:化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。
资料3:化学反应的能量变化(ΔH)与反应物和生成物的键能有关。在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(ΔH)。
根据以上资料回答下列问题:
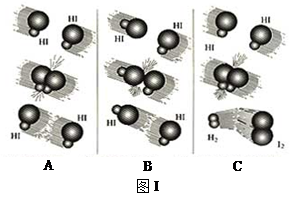
(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是
__________________(选填“A”、“B”或“C”);
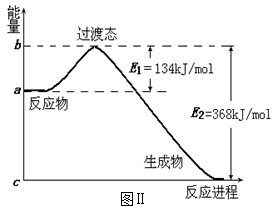
(2)图Ⅱ是1molNO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO
反应的热化学方程式:
___________________________________________;
(3) 下表是部分化学键的键能数据:
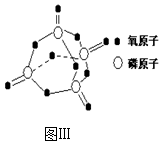
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构(P4O10)如图Ⅲ所示,则上表中
X=_______________________________。
(4)图Ⅳ为氧族元素的氢化物a、b、c、d的生成热数据示意图。
请你归纳:非金属元素的氢化物的稳定性与氢化物的生成热(ΔH)
之间的关系:_____________________________________。
查看答案和解析>>
科目:高中化学 来源:2010年湖南省浏阳一中高二上学期第三次阶段性测试化学卷 题型:填空题
(12分)将化学知识系统化,有助于对化学问题的进一步认识和理解。
资料1:化学反应的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
资料2:化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。
资料3:化学反应的能量变化(ΔH)与反应物和生成物的键能有关。在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(ΔH)。
根据以上资料回答下列问题: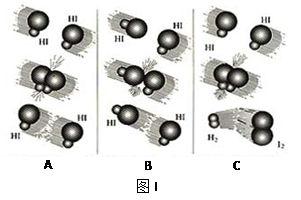
(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是
__________________(选填“A”、“B”或“C”);
(2)图Ⅱ是1molNO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO
反应的热化学方程式:
___________________________________________;
(3) 下表是部分化学键的键能数据: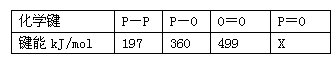
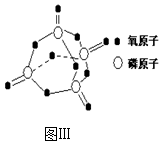
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构(P4O10)如图Ⅲ所示,则上表中
X=_______________________________。
(4)图Ⅳ为氧族元素的氢化物a、b、c、d的生成热数据示意图。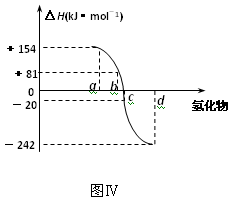
请你归纳:非金属元素的氢化物的稳定性与氢化物的生成热(ΔH)
之间的关系:_____________________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省高三一轮检测化学试卷(解析版) 题型:填空题
(10分)下表是部分短周期元素的原子半径及主要化合价:
|
元素代号 |
W |
R |
X |
Y |
Z |
Q |
M |
|
原子半径/nm |
0.037 |
0.186 |
0.074 |
0.075 |
0.077 |
0.150 |
0.160 |
|
主要化合价 |
+1 |
+1 |
-2 |
-3、+5 |
+2、+4 |
+3 |
+2 |
试用化学用语回答下列问题:
(1)七种元素中原子半径最大的元素在周期表中位置是 。
M在Z的最高价氧化物中燃烧的化学方程式 。
(2)X可与W组成含18电子的化合物甲,甲的电子式为 ;R与X形成化合物乙R2X,用电子式表示乙的形成过程_____________________________
(3)写出Q与R最高价氧化物对应水化物反应的离子方程式_____________________。
(4)Y的氧化物是主要大气污染物之一,写出一种与之有关的污染现象______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com