


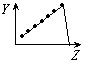
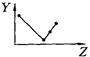
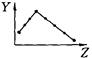
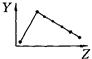


科目:高中化学 来源:不详 题型:填空题
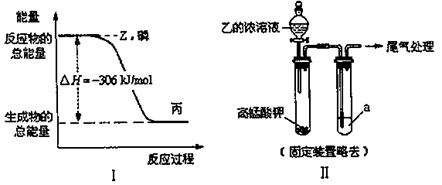
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 2 | | | 讲 台 | | | 3 |
| ||||||
| 5 | 6 | 7 | 8 | | 9 | 10 | 11 | 12 | ||||||
| 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | |||||||
| 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | |||||||
| 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | |||||||
| 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | |||||||
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Y的单质能将X从NaX的溶液中置换出来 |
| B.X的氢化物的沸点比Y的氢化物的沸点低 |
| C.X与H2化合放出的能量比Y与H2化合放出的能量少 |
| D.X的气态氢化物比Y的气态氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
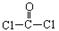 每个COCl2分子内含有 个δ键, 个π键。其中心原子采取 杂化轨道方式。
每个COCl2分子内含有 个δ键, 个π键。其中心原子采取 杂化轨道方式。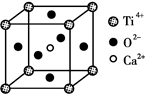
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com