
电解液中含有K+、Cl-、SO![]() 、OH-(少量)、Cu2+、H+(少量),用两个石墨电极电解时,阳极析出__________,电极反应式是 ;阴极析出__________,电极反应式是 。若改用两个铜电极电解时,则阳极的变化是 ,电极反应式是______________;阴极析出______________,电极反应式是______________。
、OH-(少量)、Cu2+、H+(少量),用两个石墨电极电解时,阳极析出__________,电极反应式是 ;阴极析出__________,电极反应式是 。若改用两个铜电极电解时,则阳极的变化是 ,电极反应式是______________;阴极析出______________,电极反应式是______________。
科目:高中化学 来源: 题型:阅读理解
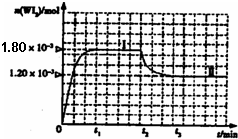 (2010?枣庄一模)卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.
(2010?枣庄一模)卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.

| ||
| ||
| 0.036 |
| t1 |
| 0.036 |
| t1 |
| [WI2] |
| [W][I2] |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | 沸点/℃ | 在水中 | 在乙醚中 |
| TiC14 | 136 | 强烈水解 | 易溶 |
| SiCl4 | 58 | 强烈水解 | 易溶 |
| FeCl3 | 303(升华) | 水解 | 易溶 |
| F | 2- 6 |
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
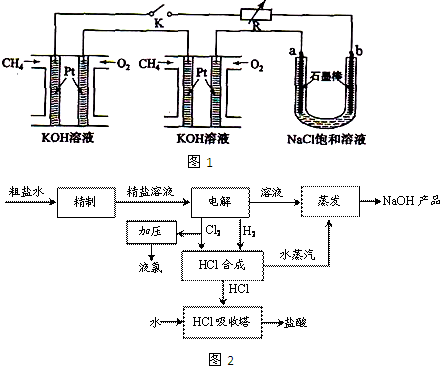
![]() 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。
碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶
于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质
碘。以碘为原料,通过电解制备碘酸钾的实验装置如右图所示。
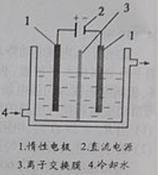
![]() 请回答下列问题:
请回答下列问题:
(1)碘是 (填颜色)固体物质,实验室常用
方法来分离提纯含有少量杂质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:
3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。
电解时,阳极上发生反应的电极反应式为 ;阴极上观察到的实验现象是 。
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I—。请设计一个检验电解液中是否有I—的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。![]()
![]()
![]() w_w w. k#s5_u.c o*m
w_w w. k#s5_u.c o*m
| 实验方法 | 实验现象及结论 |
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
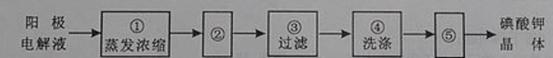
步骤②的操作名称是 ,步骤⑤的操作名称是 。步骤④洗涤晶体的目的是
。
查看答案和解析>>
科目:高中化学 来源:2014届浙江省高一下学期期中考试化学试卷(解析版) 题型:选择题
以硫酸铜溶液作电解液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼。下列叙述正确的是
① 粗铜与直流电源负极相连
② 阴极发生的反应为Cu2+ + 2e- = Cu
③ 电路中每通过3.01×1023个电子,得到的精铜质量为16 g
④ 杂质Ag以Ag2SO4的形式沉入电解槽形成“阳极泥”k
A.②③ B.②④ C. ③④ D.①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com