
Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是
A.Na2O2只作氧化剂 B.Na2FeO4既是氧化产物又是还原产物
C.O2是还原产物 D.2 mol FeSO4发生反应时,反应中共有8 mol电子转移
科目:高中化学 来源: 题型:
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
[实验一] 测定硫元素的含量
Ⅰ.将m1 g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处持续不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。
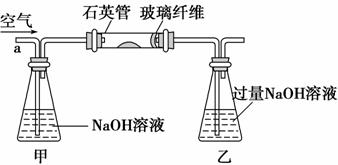
Ⅱ.反应结束后,将乙瓶中的溶液按下述流程进行处理。
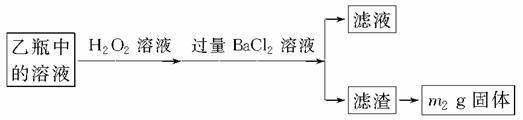

[实验二] 测定铁元素的含量
Ⅲ.测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释 至250 mL;
至250 mL;
④每次取稀释液25.00 mL,用物质的量浓度为c mol·L-1的酸性KMnO4溶液滴定。三次滴定实验所需KMnO4溶液体积的平均值为V mL(该反应中还原产物为Mn2+)。
请完成下列问题:
(1)已知12 g FeS2完全燃烧放热85.3 kJ,则表示FeS2燃烧热的热化学方程式是_______________________________________________________________________。
(2)Ⅰ中乙瓶内发生反应的离子方程式有_______________________________________________________________________。
Ⅰ中玻璃纤维的作用是_______________________________________________。
(3)Ⅱ中的滤渣在称量前还应进行的操作是_______________________________。
(4)Ⅲ的步骤③中,需要用到的仪器除烧杯、玻璃棒、量筒、胶头滴管外,还有________________。
(5) 该黄铁矿中铁元素的质量分数________________(用Ⅰ、Ⅲ中有关实验数据表达)。
该黄铁矿中铁元素的质量分数________________(用Ⅰ、Ⅲ中有关实验数据表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)分子式为C4H10O并能与金属钠反应放出H2的有机化合物有________种。
(2)与化合物C7H10O2互为同分异构体的物质不可能为________。
A.醇 B.醛
C.羧酸 D.酚
(3)与具有相同官能团的同分异构体的结构简式为___________________。
(4)苯氧乙酸( )有多种酯类的同分异构体。其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是________________________________________________________________________
)有多种酯类的同分异构体。其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是________________________________________________________________________
________________________________________________________________________
_________________________________________________(写出任意2种的结构简式)。
(5)分子式为C5H10的烯烃共有(不考虑顺反异构)________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
固体混和物,可能含有氯化钙、碳酸铵、烧碱、硫酸铵,将它溶解于水得到无色澄清的溶液,无其它明显现象,向溶液中加入硝酸钡溶液,产生白色沉淀,再加入硝酸沉淀部分溶解,则原混合物肯定有 ( )
A.CaCl2和(NH4)2SO4 B.(NH4)2SO4和(NH4)2CO3
C.NaOH和CaCl2 D.NaOH和(NH4)2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
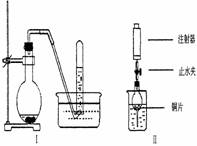 下图是铜与稀硝酸反应的两个实验装置图,请回答下列问题:
下图是铜与稀硝酸反应的两个实验装置图,请回答下列问题:
(1)铜与稀硝酸反应的离子方程式 。
(2)I实验装置中能否证明铜与稀硝酸反应生成的是NO气体______(填“能”或“不能”),简述理由
。
(3)若用Ⅱ实验装置进行实验,以证明铜与稀硝酸反应生成的气体是NO, 在烧杯中加入一定体积的稀硝酸,打开止水夹,用注射器慢慢抽取干燥管内的空气,稀硝酸沿着干燥管慢慢上升,直到充满整个干燥管,停止抽拉注射器,关闭止水夹,观察干燥管内的现象___________________ 。
反应停止后,打开止水夹,用注射器抽取干燥管内的气体(事先已将注射器内原有的空气推出),关闭止水夹后取下注射器,并抽取一定量的空气,观察到的现象是____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
固体粉末X中可能含有Fe、FeO、CuO、MnO2、KCl和K2CO3中的若干种。为确定该固体粉末的成分,某同学依次进行了以下实验:
①将X加入足量水中,得到不溶物Y和溶液Z
②取少量Y加入足量浓盐酸,加热,产生黄绿色气体,并有少量红色不溶物
③向Z溶液中滴加AgNO3溶液,生成白色沉淀
④用玻璃棒蘸取溶液Z于广泛pH试纸上,试纸呈蓝色 分析以上实验现象,下列结论正确的是
A.X中一定不存在FeO B.不溶物Y中一定含有Fe和CuO
C.Z溶液中一定含有KCl、K2CO3 D.Y中不一定存在MnO2
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组以废弃的易拉罐、漂白粉、氢氧化钠等为原料制造了一种新型环保电池,并进行相关实验,如图所示。电池的总反应方程式为2Al+3ClO-+2OH-===3Cl-+2AlO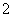 +H2O。下列说法正确的是
+H2O。下列说法正确的是
A.电池的负极反应式为:ClO-+H2O+2e-===Cl-+2OH-
B.当有0.1 mol Al完全溶解时,流经电解液的电子 数为1.806×1023个
C.往滤纸上滴加酚酞试液,b极附近颜色变红
D.b极附近会生成蓝色固体
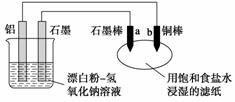
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
①氯气与水反应:Cl2 +H2O===2H++Cl-+ClO-
+H2O===2H++Cl-+ClO-
②氯气与氢氧化钠溶液反应:Cl2+2OH-===Cl-+ClO-+H2O
③浓盐酸与二氧化锰共热:MnO2+4HCl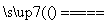 Mn2++Cl2↑+2H2O+2Cl-
Mn2++Cl2↑+2H2O+2Cl-
④漂白粉溶液中通入少量的二氧化碳气体:Ca2++2ClO-+H2O+CO2===CaCO3↓+2HClO
A.①③ B.②④
C.②③ D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com