
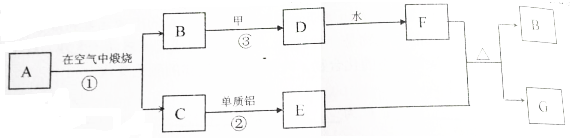
分析 A,C都是由两种元素组成的固态化合物,E是过渡元素的单质,甲是短周期元素的气体单质,
(1)若A是黄色固体,反应①用于工业生产,则A应为FeS2,FeS2在空气中煅烧生成固体C为Fe2O3,B为SO2,C与铝发生铝热反应生成E为Fe,B与氧气生成三氧化硫,所以D为SO3,三氧化硫与水反应生成F为H2SO4,铁与浓硫酸加热生成硫酸铁和二氧化硫,G为Fe2(SO4)3,符合各物质转化关系;
(2)若A,C都是黑色固体,A经反应①生成C时,固体质量不变,则A应为Cu2S,Cu2S在空气中煅烧生成固体C为CuO,B为SO2,CuO与铝发生氧化还原反应生成E为Cu,B与氧气生成三氧化硫,所以D为SO3,三氧化硫与水反应生成F为H2SO4,铜与浓硫酸加热生成硫酸铜和二氧化硫,G为CuSO4,符合各物质转化关系;
(3)反应③是工业上制硫酸中的二氧化硫的催化氧化.
解答 解:A,C都是由两种元素组成的固态化合物,E是过渡元素的单质,甲是短周期元素的气体单质,
(1)若A是黄色固体,反应①用于工业生产,则A应为FeS2,FeS2在空气中煅烧生成固体C为Fe2O3,B为SO2,C与铝发生铝热反应生成E为Fe,B与氧气生成三氧化硫,所以D为SO3,三氧化硫与水反应生成F为H2SO4,铁与浓硫酸加热生成硫酸铁和二氧化硫,G为Fe2(SO4)3,反应①的化学方程式为,
故答案为:FeS2;4FeS2+11O2$\frac{\underline{\;煅烧\;}}{\;}$2Fe2O3+8SO2;
(2)若A,C都是黑色固体,A经反应①生成C时,固体质量不变,则A应为Cu2S,Cu2S在空气中煅烧生成固体C为CuO,B为SO2,CuO与铝发生氧化还原反应生成E为Cu,B与氧气生成三氧化硫,所以D为SO3,三氧化硫与水反应生成F为H2SO4,铜与浓硫酸加热生成硫酸铜和二氧化硫,G为CuSO4,符合各物质转化关系,
故答案为:Cu2S;
(3)反应③是工业上制硫酸中的二氧化硫的催化氧化,反应条件为铁触媒作催剂,500℃,
故答案为:铁触媒作催剂,500℃.
点评 本题考查无机物推断,涉及S元素化合物性质与转化等,以A的颜色为突破口进行推断,需要学生熟练掌握元素化合物知识,灵活运用元素化合物知识在工业中的应用,难度中等.


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 配制氯化铁溶液时,加入少量稀盐酸 | |
| B. | 配制氯化亚铁溶液时,加入少量铁屑 | |
| C. | 在含有酚酞的氨水中加入少量NH4Cl,溶液颜色会变浅 | |
| D. | 在硫酸铜饱和溶液中加入一块胆矾,晶体外形变规则 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④、③ | B. | ④、② | C. | ①、② | D. | ③、① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 完全沉淀时的pH值 | 3.2 | 5.2 | 10.4 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+HNO3(浓)→Cu(NO3)2 | B. | Cu+HNO3(稀)→Cu(NO3)2 | ||
| C. | Cu$\stackrel{空气}{→}$CuO$\stackrel{稀硝酸}{→}$Cu(NO3)2 | D. | Cu+AgNO3→Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰醋酸与食用醋有相同的气味 | |
| B. | 乙烯、氯乙烯、苯乙烯都可用于合成有机高分子材料 | |
| C. | 苯能与溴发生反应,因此不能用苯萃取溴水中的溴 | |
| D. | 淀粉和纤维素水解的最终产物都是葡萄糖,因此二者互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com