
取含MnO2的软锰矿石27.86g,跟足量浓盐酸反应,制得5.6L氯气(该状态下Cl2密度为3.17g/L)计算:
(1)这种软锰矿石中MnO2的质量分数?
(2)被氧化的HCl为多少g?
(1)78.1% (2)18.25
【解析】
试题分析:解:(1)设该27.86g含有的MnO2的质量为x,被氧化的HCl的质量为y,根据
MnO2 + 4HCl(浓) = MnCl2 + Cl2↑
87 146 71
x y 3.17×5.6=17.752g
即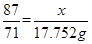 ,解得
,解得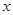 =21.752,
=21.752,
所以这种软锰矿石中MnO2的质量分数=21.752/27.86×100%="78.1%" ;
 解得y=36.50g,即参加反应的HCl为36.50g,
解得y=36.50g,即参加反应的HCl为36.50g,
即被氧化的HCl=1/2×36.50=18.25g。
考点:利用化学反应方程式的简单计算,氧化还原反应
点评:本题考查了化学反应方程式的简单计算,该题难度适中,但是要注意5.6L的氯气并不是在标准状况下的。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:安徽省宿州市十三所重点中学2011-2012学年高二下学期期中质量检测化学文科试题 题型:038
取含MnO2的软锰矿17.4 g与足量浓HCl反应后,将生成的Cl2通入含22 g NaBr(过量)的水溶液中,经加热蒸发水分并烘干后,质量减少了8.9 g,剩余13.1 g的残渣.计算:
(1)生成NaCl多少克?
(2)生成Cl2(标准状况下)体积多少升?
(3)软锰矿含MnO2的质量分数.
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)取含MnO2的软锰矿17.4g与足量浓HCl反应后,将生成的Cl2通入含22g NaBr(过量)的水溶液中,经加热蒸发水分并烘干后,质量减少了8.9g,剩余13.1g的残渣。计算:
(1)生成 NaCl多少克?
(2)生成Cl2(标准状况下)体积多少升?
(3)软锰矿含MnO2的质量分数。
查看答案和解析>>
科目:高中化学 来源:2011-2012年安徽宿州13校高二下学期期中联考文科化学试卷(带解析) 题型:计算题
(12分)取含MnO2的软锰矿17.4g与足量浓HCl反应后,将生成的Cl2通入含22g NaBr(过量)的水溶液中,经加热蒸发水分并烘干后,质量减少了8.9g,剩余13.1g的残渣。计算:
(1)生成 NaCl多少克?
(2)生成Cl2(标准状况下)体积多少升?
(3)软锰矿含MnO2的质量分数。
查看答案和解析>>
科目:高中化学 来源:2011-2012年安徽宿州13校高二下学期期中联考文科化学试卷(解析版) 题型:计算题
(12分)取含MnO2的软锰矿17.4g与足量浓HCl反应后,将生成的Cl2通入含22g NaBr(过量)的水溶液中,经加热蒸发水分并烘干后,质量减少了8.9g,剩余13.1g的残渣。计算:
(1)生成 NaCl多少克?
(2)生成Cl2(标准状况下)体积多少升?
(3)软锰矿含MnO2的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com