
| A.①②③ | B.②③④ | C.②③ | D.①②③④ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
| A.增大阴极碳钢网面积 |
| B.提高饱和氯化钠溶液的温度 |
| C.加大阴极与阳极间的距离 |
| D.提高电解时的电源电压 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
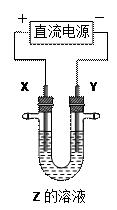
 产。下列说法中正确的是
产。下列说法中正确的是
A.氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠 | B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4  | C.电镀工业中,X是待镀金属,Y是镀层金属 | D.外加电流的阴极保护法中,Y是待保护金属 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
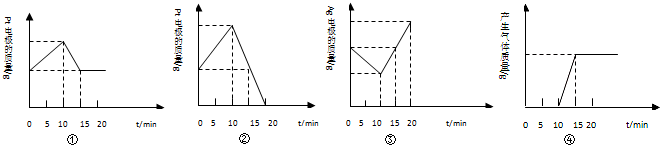
| A.①③ | B.①②③ | C.②③④ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解过程产生的气体体积(在标准状况下)为5.6L | ||||
| B.电解过程转移的电子数为3.612×1023个 | ||||
| C.加入碱式碳酸铜的反应是:Cu2(OH)2CO3+2H2SO4═2CuSO4+CO2↑+3H2O | ||||
D.电解过程只发生了2CuSO4+2H2O
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电源A上的a极是正极 |
| B.d极上的电极反应方程式为2Cl--2e-=Cl2↑ |
| C.e、f极上产生的气体体积比为2:1 |
| D.电解槽C中溶液的pH增大 |
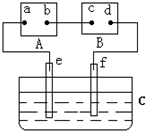
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.22.4ax/b | B.11.2ax/b | C.5.6ax/b | D.2.5ax/b |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
| 腐蚀快慢 | 较快 | 慢 | 较快 | ||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- | |||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com