
【题目】将0.01mol下列物质分别加入l00mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)
①Na2O2 ②Na2O ③Na2SO4 ④NaCl
A.①>②>③>④B.①>②>④>③C.①=②>③>④D.①=②>③=④
【答案】D
【解析】
Na2O2与Na2O加入水中发生化学变化,溶液中的溶质是NaOH。
加入物质前后溶液体积变化忽略不计
①Na2O2与水反应的化学方程式为:2Na2O2+2H2O![]() 4Na++4OH-+O2↑,0.01mol Na2O2与水反应生成OH-的物质的量为0.02mol,c(OH-)=0.02mol÷0.1L=0.2 mol·L-1;
4Na++4OH-+O2↑,0.01mol Na2O2与水反应生成OH-的物质的量为0.02mol,c(OH-)=0.02mol÷0.1L=0.2 mol·L-1;
②Na2O与水反应的化学方程式为:Na2O+H2O![]() 2Na++2OH-,0.01mol Na2O与水反应生成OH-的物质的量为0.02mol,c(OH-)=0.02mol÷0.1L=0.2 mol·L-1;
2Na++2OH-,0.01mol Na2O与水反应生成OH-的物质的量为0.02mol,c(OH-)=0.02mol÷0.1L=0.2 mol·L-1;
③0.01mol Na2SO4加入l00mL蒸馏水中,c(SO42-)=0.01mol/0.1L=0.1 mol·L-1;
④0.01mol NaCl加入l00mL蒸馏水中,c(Cl-)=0.01mol÷0.1L=0.1 mol·L-1;
将0.01mol下列物质分别加入l00mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计):①=②>③=④,D正确;
答案选D。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料。工业上利用下列反应来检查氯气管道是否漏气:3Cl2+8NH3=N2+6NH4Cl,下列说法错误的是
A. 若有白烟产生则管道漏气 B. 该反应中NH4Cl是还原产物
C. 反应中NH3只显还原性 D. 生成1.4gN2时转移0.3mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铁具有较强的氧化性,易溶于水,乙醇等,微溶于浓硝酸。可用于金属表面化学抛光剂。
(1)制备硝酸铁
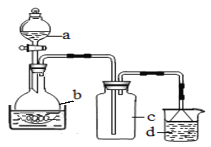
取100mL 8mol· L-1硝酸于a中,取 5.6g铁屑于b中,水浴保持反应温度不超过70℃。
①b中硝酸与铁屑混合后,铁屑溶解,溶液变黄色,液面上方有红棕色气体。写出b中发生反应的离子方程式:_______。
②若用实验制得的硝酸铁溶液,获取硝酸铁晶体,应进行的操作是:将溶液小心加热浓缩、_________、___________,用浓硝酸洗涤、干燥。
(2)探究硝酸铁的性质。用硝酸铁晶体配制0.1mol·L-1硝酸铁溶液,溶液呈黄色,进行实验如下:
实验一:硝酸铁溶液与银反应:
i.测0.1mol·L-1硝酸铁溶液pH约等于1.6 。
ii.将5mL 0.1mol·L-1硝酸铁溶液加到有银镜的试管中,约1min银镜完全溶解。使银镜溶解的反应原理有两个反应:
a. Fe3+使银镜溶解 b. NO3-使银镜溶解
①证明Fe3+使银镜溶解,应辅助进行的实验操作是_________。
②用5mL __________溶液,加到有银镜的试管中,约1.2min银镜完全溶解。证明NO3-使银镜溶解。
③为进一步研究溶解过程,用5mLpH约等于1.6的0.05mol·L-1硫酸铁溶液,加到有银镜的试管中,约10min银镜完全溶解。
实验二:硝酸铁溶液与二氧化硫反应,用如图所示装置进行实验:
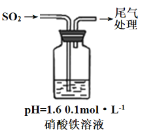
i.缓慢通入SO2,溶液液面上方出现红棕色气体,溶液仍呈黄色。
ii.继续持续通入SO2,溶液逐渐变为深棕色。
已知:Fe2++NO[Fe(NO)]2+(深棕色)
④步骤i反应开始时,以NO3-氧化SO2为主,理由是:_________。
⑤步骤ii后期反应的离子方程式是__________。
(3)由以上探究硝酸铁的性质实验得出的结论是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 用玻璃棒蘸取某溶液进行焰色反应实验,火焰呈黄色 | 溶液中含有Na+ |
B | 向浓度均为0.1 mol·L-1的FeCl3和AlCl3混合溶液中滴加NaOH溶液,出现红褐色沉淀。 | Ksp[Fe(OH)3]<Ksp[Al(OH)3] |
C | 室温下,用pH试纸测得:0.1 mol·L-1Na2CO3溶液的pH约为11;0.1 mol·L-1NaHCO3溶液的pH约为8。 | HCO3-结合H+的能力比CO32-的强 |
D | 用Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别清洗做完银镜反应的试管,FeCl3溶液清洗得干净 | 存在可逆过程: Fe3++Ag |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以酚酞为指示剂,用0.1000 mol·L1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数![]() 随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2的分布系数:
随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2的分布系数:![]() ]
]

下列叙述正确的是
A. 曲线①代表![]() ,曲线②代表
,曲线②代表![]()
B. H2A溶液的浓度为0.2000 mol·L1
C. HA的电离常数Ka=1.0×102
D. 滴定终点时,溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机碱,例如二甲基胺(![]() )、苯胺(
)、苯胺(![]() ),吡啶(
),吡啶(![]() )等,在有机合成中应用很普遍,目前“有机超强碱”的研究越来越受到关注,以下为有机超强碱F的合成路线:
)等,在有机合成中应用很普遍,目前“有机超强碱”的研究越来越受到关注,以下为有机超强碱F的合成路线:
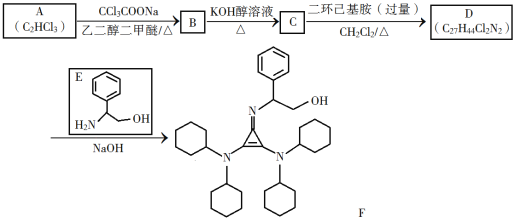
已知如下信息:
①H2C=CH2![]()
![]()
②![]() +RNH2
+RNH2![]()
![]()
③苯胺与甲基吡啶互为芳香同分异构体
回答下列问题:
(1)A的化学名称为________。
(2)由B生成C的化学方程式为________。
(3)C中所含官能团的名称为________。
(4)由C生成D的反应类型为________。
(5)D的结构简式为________。
(6)E的六元环芳香同分异构体中,能与金属钠反应,且核磁共振氢谱有四组峰,峰面积之比为6∶2∶2∶1的有________种,其中,芳香环上为二取代的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol/L的K2SO4溶液、0.2mol/L的Al2(SO4)3溶液和纯水混合,要使混合液中K+ 、Al3+、 SO42-的浓度分别为0.1mol/L、0.1mol/L、0.2mol/L,则所取三者的体积比是(假定混合后的体积不变)( )
A.1:1:1 B.2:1:2 C.1:1:2 D.2:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液。 用0.100mol![]() L-1硫酸滴定,写出该中和反应的热化学方程式____________(中和热ΔH=-57.3 kJ/mol)。将该烧碱样品配成500mL待测溶液需要的玻璃仪器有_________________________。
L-1硫酸滴定,写出该中和反应的热化学方程式____________(中和热ΔH=-57.3 kJ/mol)。将该烧碱样品配成500mL待测溶液需要的玻璃仪器有_________________________。
(3)滴定过程中,眼睛应注视_________________,若用酚酞作指示剂达到滴定终点颜色变化是____________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是_____molL-1,烧碱样品的纯度是____(保留小数点后两位)
滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(5)下列实验操作会对滴定结果产生什么后果?(填“偏高”“偏低”或“无影响”)
① 观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果____。
② 若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、铝、铁是三种重要的金属。请回答:
(1)从煤油中取出一块钠,用滤纸吸净其表面的煤油,用小刀切下一小块,钠块表面很快变暗,该反应的氧化产物为__________;将一小块钠放入坩埚中加热,反应现象为:________________________,反应的化学方程式是______________________。以上反应表明金属钠具有强的______性(填“氧化”或 “还原”)。
(2)铝和氢氧化钠反应的化学方程式为:___________________________________;如果产生的气体在标准状态下的体积为2.24L,即反应转移的电子数为____NA;
(3)已知: Fe2O3+2Al![]() Al2O3+2Fe,该反应中作为还原剂的是________,还原产物是 _______;标出电子转移的方向和数目_______________________________。
Al2O3+2Fe,该反应中作为还原剂的是________,还原产物是 _______;标出电子转移的方向和数目_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com