
| 选项 | 环境要求 | 离子或分子 |
| A | Al2(SO4)3溶液中 | K+,AlO${\;}_{2}^{-}$,Cl-,NO${\;}_{3}^{-}$ |
| B | 滴加石蕊试液显蓝色的溶液中 | Na+,K-,SO${\;}_{3}^{2-}$,S2- |
| C | 水电离产生的c(OH-)=10-12mol•L-1的溶液 | ClO-,CO${\;}_{3}^{2-}$,NH${\;}_{4}^{+}$,K- |
| D | 氯气中 | O2,NH3,CO2,HCl |
| A. | A | B. | B | C. | C | D. | D |
分析 A.离子之间相互促进水解;
B.滴加石蕊试液显蓝色的溶液,显碱性;
C.水电离产生的c(OH-)=10-12mol•L-1的溶液,为酸或碱溶液;
D.氯气具有氧化性.
解答 解:A.AlO2-、Al3+相互促进水解,不能共存,故A不选;
B.滴加石蕊试液显蓝色的溶液,显碱性,该组离子之间不反应,可大量共存,故B选;
C.水电离产生的c(OH-)=10-12mol•L-1的溶液,为酸或碱溶液,酸溶液中不能大量存在ClO-、CO32-,故C不选;
D.氯气具有氧化性,与NH3发生氧化还原反应不能共存,且NH3与HCl反应不能共存,故D不选;
故选B.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙炔的结构式为CH≡CH | B. | 甲烷分子的比例模型为 | ||
| C. | 碳原子的结构示意图为  | D. | 碳原子最外层电子的轨道表示式为 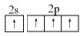 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
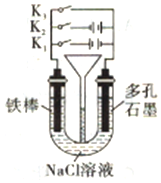
| A. | 铁腐蚀的速度由大到小的顺序:只闭合K3>只闭合K1>都断开>只闭合K2 | |
| B. | 只闭合K3,正极的电极反应式:2H2O+O2+4e-=4OH- | |
| C. | 先只闭合K1,一段时间后,漏斗内液曲上升,然后再只闭合K2,漏斗内液面上升 | |
| D. | 只闭合K2,U型管左、右两端液面均下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2-的结构示意图: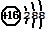 | |
| B. | 过氧化氢的电子式: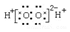 | |
| C. | Ge原子的简化电子排布式:[Ar]4s24p2 | |
| D. | 氯化钠的分子式:NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
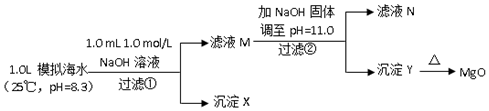
| 模拟海水中的离子浓度/ (mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给试管中的铜与浓硫酸加热,发现试管底部有白色固体并夹杂有少量黑色物质,此白色固体为硫酸铜,黑色固体为氧化铜 | |
| B. | SO2通入足量的Fe(NO3)3稀溶液中,溶液有棕黄色变为浅绿色,但立即又变成棕黄色,说明氧化性:HNO3>Fe3+>稀硫酸 | |
| C. | 向偏铝酸钠溶液通入少量的二氧化碳,生成白色沉淀和碳酸钠,说明HCO3-和AlO2-不能共存 | |
| D. | 在铝制容器中加入食盐溶液,再将变量的银器浸入该溶液中,一段时间后发现黑色会褪去,是因为银器表面Ag2S和金属铝构成原电池而发生了反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com