


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
| A、向溴乙烷中滴加硝酸银溶液和稀硝酸时,有淡黄色沉淀产生 |
| B、配制Cu(OH)2悬浊液:在一定量CuSO4溶液中,加入少量NaOH溶液 |
C、 制备乙酸乙酯:用如图所示的实验装置 |
| D、鉴别环己烯和苯:将溴的四氯化碳溶液分别滴加到少量环己烯和苯中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c1:c2=2:3 |
| B、X、Y的转化率不相等 |
| C、平衡时,Y和Z的生成速率之比为3:4 |
| D、c1的取值范围为0<c1<0.28 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
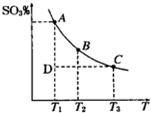
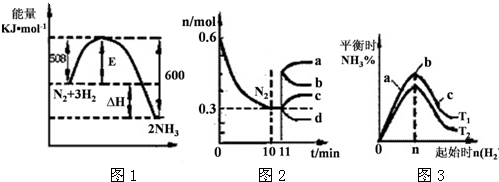
查看答案和解析>>
科目:高中化学 来源: 题型:
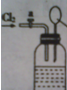 向如图所示连有一甲烷气球并盛有一定量饱和硝酸银溶液的实验装置通入足量氯气,假设氯气在饱和硝酸银溶液中不溶解:
向如图所示连有一甲烷气球并盛有一定量饱和硝酸银溶液的实验装置通入足量氯气,假设氯气在饱和硝酸银溶液中不溶解:查看答案和解析>>
科目:高中化学 来源: 题型:
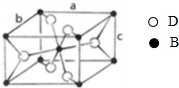 A、B、C、D四种元素的原子序数依次递增,A、B的基态原子中L层未成对电子数分别为3、2,C在短周期主族元素中电负性最小,D元素被称为继铁、铝之后的第三金属,其合金多用于航天工业,被誉为“21世纪的金属”,其基态原子外围电子占据两个能级且各能级电子数相等.请回答下列问题:
A、B、C、D四种元素的原子序数依次递增,A、B的基态原子中L层未成对电子数分别为3、2,C在短周期主族元素中电负性最小,D元素被称为继铁、铝之后的第三金属,其合金多用于航天工业,被誉为“21世纪的金属”,其基态原子外围电子占据两个能级且各能级电子数相等.请回答下列问题:| 2 |
| 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com