
 2NaOH+H2↑+Cl2↑(2分)
2NaOH+H2↑+Cl2↑(2分) 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。

科目:高中化学 来源:不详 题型:单选题
 2Ni(OH)2 。根据此反应判断,下列叙述中不正确的是( )
2Ni(OH)2 。根据此反应判断,下列叙述中不正确的是( )| A.放电时,电池负极周围溶液的pH不断增大 | B.电池充电时,镍元素在阳极被氧化 |
| C.电池放电时,H2是负极 | D.电池充电时,H2在阴极生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
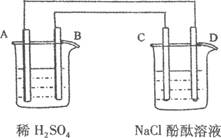
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

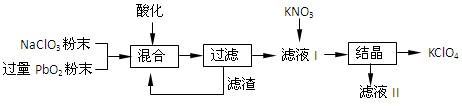
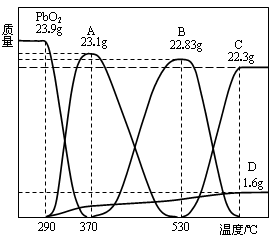
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
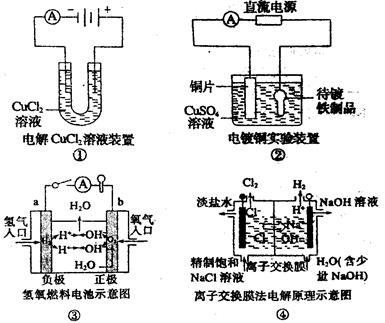
| A.①装置中阴极处产生的气体能够使湿润淀粉KI试纸变蓝 |
| B.②装置中待镀铁制品应与电源正极相连 |
| C.③装置中电子由b极流向a极 |
| D.④装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
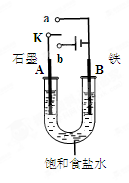
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
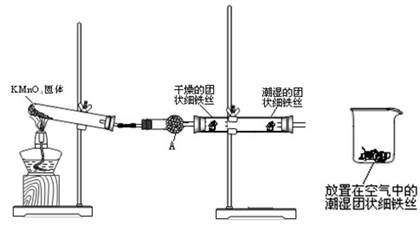

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铁表面镀铜,铜作阳极 |
| B.船底镶嵌锌块,锌作负极,以防船体被腐蚀 |
C.钢铁吸氧腐蚀的正极反应: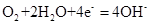 |
| D.电解精炼铜时,阳极溶解的铜与阴极析出的铜质量相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
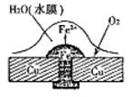
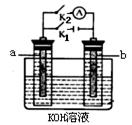
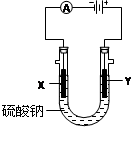
 (2)图2中a、b是多孔石墨电极,断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,b极上的电极反应式为 ,OH-向 (填a或b)极移动。然后断开K1,闭合K2,观察到电流计A的指针有偏转。b极上的电极反应式为 ,OH-向 (填a或b)极移动。
(2)图2中a、b是多孔石墨电极,断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,b极上的电极反应式为 ,OH-向 (填a或b)极移动。然后断开K1,闭合K2,观察到电流计A的指针有偏转。b极上的电极反应式为 ,OH-向 (填a或b)极移动。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com