
50%
解析:从题给已知条件可知,解题时应从乙得到的氧气的量入手。
设乙分解KClO3的质量为x,甲分解KClO3的质量为y。
2KClO3 ![]() 2KCl + 3O2↑
2KCl + 3O2↑
2 mol×122.5 2 mol×74.5 3 mol×22.4
g·mol-1 g·mol-1 L·mol-1
x 0.672 L
![]() =
=![]()
解得:x=2.45 g
在4.04 g混合物中:m(KCl)=4.04 g-0.10 g-2.45 g=1.49 g。即甲分解KClO3时得到的KCl质量为1.49 g,由此可计算y:
![]() =
=![]()
解得:y=2.45 g。
故甲实验时KClO3分解的百分率为:
![]() ×100%=50%。
×100%=50%。
本题若从物质的量入手计算会更简便。
解:设乙分解KClO3的物质的量为x,甲分解KClO3的物质的量为y。
2KClO3 ![]() 2KCl + 3O2↑
2KCl + 3O2↑
2 mol 2 mol 3 mol
X ![]()
![]() =
=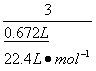 ,解得:x=0.02 mol
,解得:x=0.02 mol
在4.04 g混合物中:m(KCl)=4.04 g-0.10 g-(0.02 mol×122.5 g·mol-1)=1.49 g。即甲分解KClO3得到的KCl的质量为1.49 g,由此计算y:
2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
2 mol 2 mol
y ![]()
解得:y=0.02 mol
故甲实验时KClO3分解的百分率为:![]() ×100%=50%。
×100%=50%。


科目:高中化学 来源:物理教研室 题型:058
甲:空气→碱石灰→红磷(点燃)→水→铜粉(灼热)→集气瓶
乙:NH4NO2(加热)→浓硫酸→镁粉(灼热)→集气瓶(NH4NO2![]() N2↑+2H2O)
N2↑+2H2O)
回答下列问题:
(1)甲、乙两位学生的实验方案是否能制取氮气?甲_________、乙_________(填“能”或“不能”)。
(2)具体说明不能制取氮气的原因并纠正(若两种方案都能制氮气,此小题不用回答)_____________________________________。
(3)甲、乙方案中碱石灰和浓H2SO4可否交换位置?说明理由:___________________
___________________________________________。
(4)甲、乙两位学生按正确装置制取的氮气,用密度法测出相对分子质量(精确到0.001),进行比较:M(甲)_________________M(乙)(填“<”或“=”或“>”=。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
上述研究引起了甲、乙两位学生的极大兴趣,查阅文献后,得知钛铁矿还能被C还原:
2FeTiO3+C![]() 2Fe+2TiO2+CO2。
2Fe+2TiO2+CO2。
他们分别设计了两套实验装置模拟测定钛铁矿中可提取氧的质量分数的实验。
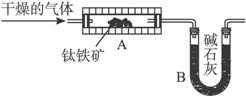
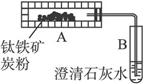
图1 图2
(1)学生甲设想用图1装置(A为电加热装置)从钛铁矿中提取氧,请写出最简便的实验步骤:____________(选填下列数字编号)。
①通入N2 ②停止通N2 ③通入H2 ④停止通H2 ⑤加热 ⑥停止加热 ⑦称取装置B的质量。
(2)学生乙设想用图2装置(A为电加热装置)从钛铁矿中提取氧,并且认为该方案的意义在于:反应产生的CO2可通过绿色植物的光合作用转化为营养物质,同时产生氧气(6O2+6H2O![]() C6H12O6+6O2)。实验过程中,称得反应前装置A中钛铁矿的质量为a g,炭粉的质量为b g,反应后装置B中产生CaCO3的质量为c g,则钛铁矿中可提取氧的质量分数的表达式为____________。
C6H12O6+6O2)。实验过程中,称得反应前装置A中钛铁矿的质量为a g,炭粉的质量为b g,反应后装置B中产生CaCO3的质量为c g,则钛铁矿中可提取氧的质量分数的表达式为____________。
(3)经专家评审后,认定两个方案都很有意义,但实验设计方面还存在不足之处,例如图2装置在加热时,还会产生CO,给实验带来误差。请提出对图2所示装置应采取的改进措施:__________。改进后,实验自始至终需持续向2装置A中通入N2的目的是_____________。
(4)科学家们选用H2而不用CO作还原剂的原因是:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两位学生用加热氯酸钾的方法制取氧气。甲取了一定质量的氯酸钾和0.10 g二氧化锰,经混合后装入试管中加热,待收集到所需氧气时停止加热。试管冷却后,乙称得甲留下的反应混合物的质量为4.04 g,将它继续加热,直到氯酸钾全部分解,得到氧气672 mL(标准状况)。求甲实验时氯酸钾分解的百分率。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安徽省蚌埠市三县联谊校高三第二次联考理综化学试卷(解析版) 题型:实验题
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4 g 铜片和含0.2 moL溶质的18.4 mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止。(假定在此过程溶液体积不变)

(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:________________
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:_____
A.铁粉 ?????? B.钠 ???? ?? C.氯化钡溶液 ???????? D.银粉
(3)为定量测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
Ⅰ甲同学设想:在A装置增加一个导管通氮气驱赶气体(假定生成的气体全部逸出),先测定生成的SO2的量,然后计算剩余硫酸的浓度。他设计了如下二种方案来测定SO2的量:
方案① 将产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀。
方案② 将气体缓缓通入足量硝酸钡溶液中,然后过滤、洗涤、干燥、称量沉淀。
经仔细分析后,发现有不合理之处,请填写下表(可以不填满):
序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
方案① |
|
|
|
方案② |
|
|
|
Ⅱ乙学生设计的方案是:分离出反应后的溶液并加蒸馏水稀释至1000 mL,取20.00 mL于锥形瓶中,滴入2~3滴酚酞指示剂,用标准NaOH溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),这种方法能否求出余酸的浓度,理由是_______________________________________。
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算,不必写操作细节)_____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com