
| ||
| ||
| 催化剂 |
| 13.5 |
| 27 |
| ||
| ||


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源:2010-2011学年江西省吉安市高三最后一次模拟考试(理综)化学部分 题型:填空题
X、Y为两种主族元素,原子序数X小于Y,它们与元素Se三种元素原子序数之和为56。已知:X有两种氧化物M和N。Y与Se是相邻周期同主族元素,其中Se可以从电解精炼铜的阳极泥中获得。从阳极泥中提取Se的流程如下:

回答下列问题:(各元素用相应的元素符号表示)
⑴写出X和Y形成的化合物的电子式 。
⑵阳极泥中Se以单质、Ag2Se、Cu2Se等形式存在。写出①中Se单质与浓硫酸反
应的化学方程式
⑶写出反应②的化学方程式为 。
⑷某温度下在容积固定的密闭容器中,下列反应达到平衡:
M(g)+H2O(g) N(g)+H2(g)
N(g)+H2(g)
|
n(M):n(H2O) |
M转化率 |
H2O转化率 |
|
1:1 |
0.5 |
0.5 |
|
1:2 |
0.67 |
0.335 |
|
1:3 |
0.75 |
0.25 |
①已知M和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l)△H=
—44kJ/mol,写出上述反应的热化学方程式 。
②该反应的平衡常数为 。该温度下,向容器中充入1molM、3mol H2O、
2mol N、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
③结合表中数据判断下列说法中正确的是
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.85
查看答案和解析>>
科目:高中化学 来源:2010-2011学年东北师大附中、哈师大附中,辽宁实验中学三校高三第二次联合模拟考试(理综 题型:填空题
X、Y为两种主族元素,原子序数X小于Y,它们与元素Se三种元素原子序数之和为56。已知:X有两种氧化物M和N。Y与Se是相邻周期同主族元素,其中Se可以从电解精炼铜的阳极泥中获得。从阳极泥中提取Se的流程如下:
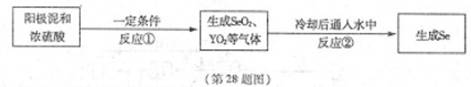
回答下列问题:(各元素用相应的元素符号表示)
(1)写出X和Y形成的化合物的电子式 。
(2)阳极泥中Se以单质、Ag2Se、Cu2Se等形式存在。写出①中Se单质与浓硫酸反应的化学方程式 。
(3)写出反应②的化学方程式为 。
(4)某温度下在容积固定的密闭容器中,下列反应达到平衡:M(g)+H2O(g)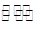 N(g)+H2(g)
N(g)+H2(g)
|
n(M):n(H2O) |
M转化率 |
H2O转化率 |
|
1:1 |
0.5 |
0.5 |
|
1:2 |
0.67 |
0.335 |
|
1:3 |
0.75 |
0.25 |
①已知M和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l)△H=—44kJ/mol,
写出上述反应的热化学方程式 。
②该反应的平衡常数为 。该温度下,向容器中充入1molM、3mol H2O、2mol N、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
③结合表中数据判断下列说法中正确的是
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.85
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题

 N(g)+H2(g)
N(g)+H2(g) 
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y为两种主族元素,原子序数X小于Y,它们与元素Se三种元素原子序数之和为56。已知:X有两种氧化物M和N。Y与Se是相邻周期同主族元素,其中Se可以从电解精炼铜的阳极泥中获得。从阳极泥中提取Se的流程如下:
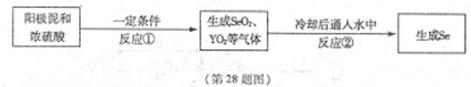
回答下列问题:(各元素用相应的元素符号表示)
(1)写出X和Y形成的化合物的电子式 。
(2)阳极泥中Se以单质、Ag2Se、Cu2Se等形式存在。写出①中Se单质与浓硫酸反应的化学方程式 。
(3)写出反应②的化学方程式为 。
(4)某温度下在容积固定的密闭容器中,下列反应达到平衡:M(g)+H2O(g)![]() N(g)+H2(g)
N(g)+H2(g)
| n(M):n(H2O) | M转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.335 |
| 1:3 | 0.75 | 0.25 |
①已知M和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l)△H=—44kJ/mol,
写出上述反应的热化学方程式 。
②该反应的平衡常数为 。该温度下,向容器中充入1molM、3mol H2O、2mol N、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
③结合表中数据判断下列说法中正确的是
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.85
查看答案和解析>>
科目:高中化学 来源:2011届东北师大附中、哈师大附中,辽宁实验中学三校高三第二次联合模拟考试(理综 题型:填空题
X、Y为两种主族元素,原子序数X小于Y,它们与元素Se三种元素原子序数之和为56。已知:X有两种氧化物M和N。Y与Se是相邻周期同主族元素,其中Se可以从电解精炼铜的阳极泥中获得。从阳极泥中提取Se的流程如下:
回答下列问题:(各元素用相应的元素符号表示)
(1)写出X和Y形成的化合物的电子式 。
(2)阳极泥中Se以单质、Ag2Se、Cu2Se等形式存在。写出①中Se单质与浓硫酸反应的化学方程式 。
(3)写出反应②的化学方程式为 。
(4)某温度下在容积固定的密闭容器中,下列反应达到平衡:M(g)+H2O(g) N(g)+H2(g)
N(g)+H2(g)
| n(M):n(H2O) | M转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.335 |
| 1:3 | 0.75 | 0.25 |
| A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低 |
| B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同 |
| C.M和H2O(g)初始物质的量之比等于二者转化率之比 |
| D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.85 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com