
����Ŀ��X��Y��Z��WΪԭ��������������Ķ���������Ԫ�أ������γɵ�ij�ֻ����������ӽṹ��ͼ������X��ZΪͬ����Ԫ�أ�Y�������������ڲ��3����W����������Ϊ�������������![]() ������˵����ȷ���ǣ���
������˵����ȷ���ǣ���

A.���⻯���ȶ��ԣ�W>Y
B.ZX��X2Y��Ӧ��ZX����ԭ����1molZXת�Ƶ�����Ϊ2NA
C.X2WY2�C���л�ԭ��
D.X��Z�ֱ���Y�γɵĶ�Ԫ�������к��еĻ�ѧ��������ȫ��ͬ
���𰸡�C
��������
X��Y��Z��WΪԭ��������������Ķ���������Ԫ�أ�Y�������������ڲ��3����W����������Ϊ�������������![]() ����֪YΪOԪ�أ�WΪPԪ�ء���������ӵĽṹͼ��X��P�γ�һ�����ۼ�����֪XΪHԪ�أ�X��Zͬ���壬��ԭ��������O��Z��P�����֪ZΪNaԪ�أ��ݴ˷������
����֪YΪOԪ�أ�WΪPԪ�ء���������ӵĽṹͼ��X��P�γ�һ�����ۼ�����֪XΪHԪ�أ�X��Zͬ���壬��ԭ��������O��Z��P�����֪ZΪNaԪ�أ��ݴ˷������
A���ǽ����ԣ�O��P������Ԫ�������ɣ��ǽ�����Խǿ����Ӧ���⻯����ȶ���Խǿ������⻯����ȶ��ԣ�O��P��A�����
B���ɷ�����֪��ZX��X2Y�ֱ�Ϊ��NaH��H2O��NaH��H2O������Ӧ��NaH+H2O=NaOH+H2����NaH��Hԭ�ӻ��ϼ�Ϊ-1�ۣ��ڷ�Ӧ�У����ϼ����ߣ�����ԭ��������������Ӧ���ɷ�Ӧ����ʽ��֪��1molNaHת�Ƶĵ�����ΪNA��B�����
C��X2WY2�CΪH2PO2-������P�Ļ��ϼ�Ϊ+1�ۣ�����ʧ���ӱ��ֻ�ԭ�ԣ�C����ȷ��
D��H��Na��O�γɵĶ�Ԫ��������H2O��H2O2��Na2O2�����й��ۼ���D�����
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20mL0.1mol/LHA��Һ�еμ�0.1mol/L�İ�ˮ����Һ��pH�氱ˮ�������ϵ��ͼ��ʾ������˵������ȷ����
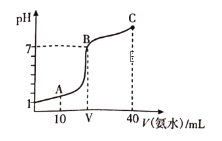
A. HA�ĵ��뷽��ʽΪHA=H++A-
B. B��ʱ����HA�Ͱ�ˮǡ����ȫ��Ӧ
C. A����ʾ��Һ�У�c(A-)=2c(NH4+)+2c(NH3��H2O)
D. C����ʾ��Һ�У�c(NH4+)>c(A-)>c(NH3��H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������Ա���HCHO(��ȩ����O2���ǻ���ʯ��HAP)���������H2O�����̣�������ʾ��ͼ���£�ͼ��ֻ������ HAP�IJ��ֽṹ����
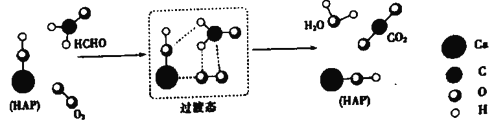
����˵������ȷ����
A. HAP�����HCHO��O2�ķ�Ӧ����
B. HCHO�ڷ�Ӧ�����У���C-H����������
C. ����ͼʾ��Ϣ��CO2�����е���ԭ��ȫ������O2
D. �÷�Ӧ�ɱ�ʾΪ��HCHO+O2![]() CO2+H2O
CO2+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������������Լ�����������ӦΪ��2NO2(g)��O3(g) ![]() N2O5(g)��O2(g)������Ӧ�ں����ܱ������н��У������ɸ÷�Ӧ���ͼ���������ж���ȷ����(����)
N2O5(g)��O2(g)������Ӧ�ں����ܱ������н��У������ɸ÷�Ӧ���ͼ���������ж���ȷ����(����)
A | B | C | D |
|
|
|
|
�����¶ȣ�ƽ�ⳣ����С | 0��3 s�ڣ���Ӧ����Ϊ��v(NO2)��0��2 mol��L��1 | t1ʱ�����������ƽ�������ƶ� | ��ƽ��ʱ�����ı�x����xΪc(O2) |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У���һ����̼��ˮ����������������ȣ��ڴ��������·�����Ӧ��CO��g����H2O��g��![]() H2��g����CO2��g������500 ��ʱ��ƽ�ⳣ��K��9������Ӧ��ʼʱ��һ����̼��ˮ������Ũ�ȶ���0.02 mol/L�����ڴ�������CO��ת����Ϊ�� ��
H2��g����CO2��g������500 ��ʱ��ƽ�ⳣ��K��9������Ӧ��ʼʱ��һ����̼��ˮ������Ũ�ȶ���0.02 mol/L�����ڴ�������CO��ת����Ϊ�� ��
A. 25% B. 50% C. 75% D. 80%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ļ�������ҽҩ��������������Ҫ���ã���ʶ�����仯��������Ҫ���塣
��1����̬��ԭ���У�����ռ�ݵ�����ܼ�����Ϊ_____________��
��2���о������������������������δ�ɶԵ���ʱ���û�������д��ԡ��������ʿ�����¼�����ŷ۵���__________��
A��V2O5 B��Fe2O3 C��ZnO D��CrO2
��3����֪Cr3+��ˮ��Һ�еĴ�����ʽΪ[Cr(H2O)6��3+���ڲ�ͬ�����£��ɴ�CrCl3ˮ��Һ�л����ɫ������ɫ����ɫ�Ȳ�ͬ��ɫ��������ʵ��ʽ��ΪCrCl36H2O����ȡ����ɫ�����0.1mol����������AgNO3��Һ�������ˡ�ϴ�ӡ������28.7g��������û������еĻ�ѧ��������___________��д��������ɫ�����ĵ��뷽��ʽ��________��
��4�������£��Ȼ�����(CrO2Cl2)�ǰ���ɫҺ�壬����CCl4��CS2���л��ܼ����ܡ�
�ٹ����Ȼ���������______�����������������Ǽ����������ӣ��ж�������______��
�ڵȵ������Ǿ�����ͬ�ļ۵�������ԭ�����ķ��ӻ����ӡ�д��һ����CCl4���ӻ�Ϊ�ȵ�����������ӣ�_______���ѧʽ����д��CS2���ӵĵ���ʽ��____________��
��5��������(CrN)�ڳ�������������������Ӧ��ǰ�����侧��ṹ�������Ȼ�����ͬ��
�ٵ��������۵���Ȼ��Ƹߵ���Ҫԭ����______��
����Cr3+���ڽ���N3�C��________����
����֪Cr3+��N3�C�뾶�ֱ�Ϊapm��bpm����Cr3+��N3�C���ǽ��ܽӴ��ĸ���С��NA���������ӵ�������ֵ��������ܶ�Ϊ��gcm�C3����CrN��Ħ������Ϊ______�����ú�a��b��NA��������ʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����![]()
![]() kJ��mol-1
kJ��mol-1
��![]()
![]() kJ��mol-1
kJ��mol-1
��![]()
![]() kJ��mol-1
kJ��mol-1
����˵����ȷ����
A.![]() ��ȼ����
��ȼ����![]() kJ��mol-1
kJ��mol-1
B.![]()
![]() kJ��mol-1
kJ��mol-1
C.�����ʵ�����![]() ��
��![]() ��ȫȼ�գ�
��ȫȼ�գ�![]() �ų�����������
�ų�����������
D.��������Һ�У�![]() ��
��![]() �����γ�ȼ�ϵ��
�����γ�ȼ�ϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ũ����ֱ�����ΰ��ϵĸ�����Һ�У��������£�
ʵ�� | ���� |
| ������Һ�������������������� |
�������������� | |
������Һ��ɫ | |
���в�������ɫ���� |
���з�����ȷ���ǣ� ��
A.��������������Ũ�����������
B.��������˵��δ������Ӧ
C.���з�Ӧ����Ԫ��ȫ����KCl��ʽ����
D.���в�������ɫ����ķ�Ӧ�ǣ�ClO��+ Cl��+ 2H+ = Cl2��+ H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����£����ԣ�HF>HCN���ֱ���1L1mol/L��HF��HCN��Һ�м�NaOH�������pH�������¶Ⱥ���Һ����ı仯������Һ�еģ�X��ʾF��CN����pH�仯��ͼ��ʾ������˵����ȷ����
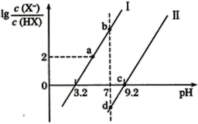
A.HF�ĵ��볣��Ka(HF)��������10-4
B.d����Һ�У�c(Na+)=c(X-)>c(HX)
C.a��b��Ĺ�����ˮ�ĵ���̶��ȱ����С
D.b����Һ��d����Һ��c(Na+)��b<d
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com