
| A. | 锗的第一电离能高于碳而电负性低于碳 | |
| B. | 乙烯分子中,只有一个碳碳π键,四个碳氢σ键 | |
| C. | 在铁制品上镀铜时,镀件为阳极,铜盐溶液为电镀液 | |
| D. | 甲醇分子内的O-C-H键角小于甲醛分子内O-C-H键角 |
分析 A.同一主族元素,其第一电离能、电负性随着原子序数的增大而减小;
B.单键中含有一个σ键,双键中含有一个σ键和一个π键;
C.电镀时,镀件作阴极,镀层金属作阳极;
D.甲醇分子内C原子的杂化方式为sp3杂化,所以O-C-H键角约为109°28′,甲醛分子内的C原子的杂化方式为sp2杂化,O-C-H键角约为120°.
解答 解:A.同一主族元素,其第一电离能、电负性随着原子序数的增大而减小,所以锗的第一电离能、电负性都低于碳,故A错误;
B.单键中含有一个σ键,双键中含有一个σ键和一个π键,则乙烯分子中,有一个碳碳π键和一个碳碳σ键,四个碳氢σ键,故B错误;
C.电镀时,镀件作阴极,镀层金属作阳极,则在铁制品上镀铜时,镀件为阴极,铜盐溶液为电镀液,故C错误;
D.甲醇分子内C原子的杂化方式为sp3杂化,所以O-C-H键角约为109°28′,甲醛分子内的C原子的杂化方式为sp2杂化,O-C-H键角约为120°,所以甲醇分子内的O-C-H键角小于甲醛分子内的O-C-H键角,故D正确.
故选D.
点评 本题考查了电负性、第一电离能、共价键的类型、电镀原理的应用、杂化理论与键角,题目难度中等,侧重于考查学生对基础知识综合应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 向FeBr2溶液中通入等物质的量的Cl2:Cl2+2Br-=2 Cl-+Br2 | |
| B. | 4mol/L NaAlO2溶液和7mol/L盐酸等体积均匀混合:4AlO2-+7H++H2O=3Al(OH)3↓+Al3+ | |
| C. | 向NaAlO2 溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| D. | NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
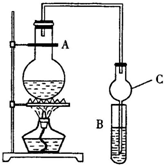 某课外活动小组设计的实验室制取较多量乙酸乙酯的装置如图所示,A中放有乙醇、无水醋酸钠和浓硫酸,B中放有饱和碳酸钠溶液(已知①无水CaCl2可与乙醇形成难溶于的CaCl2•6C2H5OH;②有关有机物的沸点,乙醚:34.7℃;乙醇:78.5℃;乙酸乙酯77.1℃),试回答:
某课外活动小组设计的实验室制取较多量乙酸乙酯的装置如图所示,A中放有乙醇、无水醋酸钠和浓硫酸,B中放有饱和碳酸钠溶液(已知①无水CaCl2可与乙醇形成难溶于的CaCl2•6C2H5OH;②有关有机物的沸点,乙醚:34.7℃;乙醇:78.5℃;乙酸乙酯77.1℃),试回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
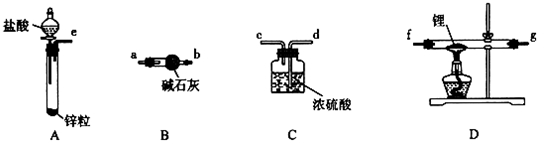
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

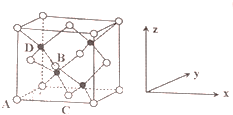
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水污染的程度是由其溶氧量来测定 | |
| B. | 污染水的金属元素如汞、镉、铅等的含量极少时,不会对生物造成伤害 | |
| C. | 使用含磷洗衣粉会造成河水、湖水污染,使海藻疯狂生长,鱼类死亡 | |
| D. | 工业所排出的废水危害水生生物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
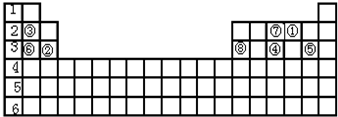
 ,与④的氢化物相比较,N的氢化物更稳定.
,与④的氢化物相比较,N的氢化物更稳定.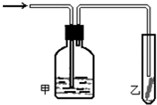
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HXO4<H2Y O4<H3ZO4 | B. | 气态氢化物的稳定性:X<Y<Z | ||
| C. | 非金属性:X>Y>Z | D. | 元素负化合价的绝对值:X>Y>Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com