
【题目】萃取碘水中的碘,可用的萃取剂是( )
①四氯化碳 ②汽油 ③酒精 ④苯 ⑤甲苯
A. 只有①④ B. ①②③④ C. ①③⑤ D. ①②④⑤
科目:高中化学 来源: 题型:
【题目】某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+ , 发现和探究过程如下.
向硝酸酸化的0.05molL﹣1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色.
(1)检验产物
①取少量黑色固体,洗涤后,(填操作和现象),证明黑色固体中含有Ag.
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有 .
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+ , 乙认为铁粉过量时不可能有Fe3+ , 乙依据的原理是(用离子方程式表示).针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测.同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3min时量小;溶液红色较3min时加深 |
ⅲ | 120 | 产生白色沉淀;较30min时量小;溶液红色较3 0min时变浅 |
(资料:Ag+与SCN﹣生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2 , 由于(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3﹣具有氧化性,可产生Fe3+;
假设d:根据现象,判断溶液中存在Ag+ , 可产生Fe3+ .
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因.实验Ⅱ可证实假设d成立.
实验Ⅰ:向硝酸酸化的溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色.
实验Ⅱ:装置如图.其中甲溶液是 , 操作现象是 . 
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗疟疾药物青蒿素可由香茅醛为原料合成.下列有关香茅醛的叙述错误的是( ) 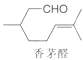
A.分子式是C10H18O
B.至少有六个碳原子处于同一平面
C.能与新制Cu(OH)2悬浊液反应
D.能与H2或Br2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家对原子结构的认识顺序正确的是
①道尔顿原子模型 ②卢瑟福原子模型 ③汤姆生原子模型 ④电子云模型
A.①②③④B.④①②③C.④②③①D.①③②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表给出的是8种元素的电负性的值.
元素 | Na | Mg | Al | Si | P | S | Cl | K |
电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
估计钙元素的电负性的取值范围( )
A.小于0.8
B.大于1.2
C.在0.8与1.2之间
D.在0.8与1.5之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A. 离子半径: O2->F->Na+>Al3+ B. O2和 O3 互为同素异形体
C.  和
和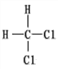 互为同分异构体 D. CH4和 C2H6 互为同系物
互为同分异构体 D. CH4和 C2H6 互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com