
科目:高中化学 来源: 题型:021
某温度下,重水(D2O)的离子积常数Kw=c(D+)×c(OD-)=1.6×10-15。可以用PH同样定义pD=-lgc(D+)。以下关于pD的叙述正确的是
( )
A. 中性溶液的pD=7.0
B. 含0.01mol的NaOD的D2O溶液1L,其pD=12.0
C. 溶有0.01molDCI的D2O溶液1L,其pD=2.0
D. 在100mL0.25mol·L-1的DCl的重水溶液中,加入50mL0.2mol·L-1的NaOD的重水溶液,最后溶液pD=1.0
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:021
( )
A. 中性溶液的pD=7.0
B. 含0.01mol的NaOD的D2O溶液1L,其pD=12.0
C. 溶有0.01molDCI的D2O溶液1L,其pD=2.0
D. 在100mL0.25mol·L-1的DCl的重水溶液中,加入50mL0.2mol·L-1的NaOD的重水溶液,最后溶液pD=1.0
查看答案和解析>>
科目:高中化学 来源:江苏省栟茶高级中学2012届高三上学期第二次调研测试化学试题 题型:058
NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得.操作步骤如下:
①用稀硫酸溶液溶解废渣,保持pH约1.5,搅拌30 min,过滤.
②向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤.
③保持滤液在40℃左右,用6%的H2O2氧化Fe2+,再在95℃加入NaOH调节pH,除去铁和铬.
④在③的滤液中加入足量Na2CO3溶液,搅拌,得NiCO3沉淀.
⑤_________.
⑥_________.
⑦蒸发、冷却结晶并从溶液中分离出晶体.
⑧用少量乙醇洗涤并凉干.
(1)步骤②除可观察到黑色沉淀外,还可嗅到臭鸡蛋气味,用离子方程式说明气体的产生:_________.
(2)步骤③中,加6%的H2O2时,温度不能过高,其原因是:_________.
(3)除铁方法有两种,一是用H2O2作氧化剂,控制pH值2~4范围内生成氢氧化铁沉淀;
另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去.下图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp=2.64×10?39).

下列说法正确的是_________(选填序号).
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10?29
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+![]() 6Fe3++Cl-+3H2O
6Fe3++Cl-+3H2O
d.工业生产中温度常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(4)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单方法是:_________.
(5)补充上述步骤⑤和⑥[可提供的试剂有6 mol/L的H2SO4溶液,蒸馏水、pH试纸].
查看答案和解析>>
科目:高中化学 来源:江苏省阜宁高级中学、大丰高级中学、栟茶高级中学2012届高三第二次调研联考化学试题 题型:022
NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得.操作步骤如下:
①用稀硫酸溶液溶解废渣,保持pH约1.5,搅拌30 min,过滤.
②向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤.
③保持滤液在40℃左右,用6%的H2O2氧化Fe2+,再在95℃加入NaOH调节pH,除去铁和铬.
④在③的滤液中加入足量Na2CO3溶液,搅拌,得NiCO3沉淀.
⑤________.
⑥________.
⑦蒸发、冷却结晶并从溶液中分离出晶体.
⑧用少量乙醇洗涤并凉干.
(1)步骤②除可观察到黑色沉淀外,还可嗅到臭鸡蛋气味,用离子方程式说明气体的产生:________.
(2)步骤③中,加6%的H2O2时,温度不能过高,其原因是:________.
(3)除铁方法有两种,一是用H2O2作氧化剂,控制pH值2~4范围内生成氢氧化铁沉淀;另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去.下图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp=2.64×10?39).
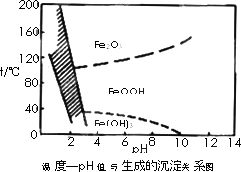
下列说法正确的是________(选填序号).
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10?29
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO![]() +6H+=6Fe3++Cl-+3H2O
+6H+=6Fe3++Cl-+3H2O
d.工业生产中温度常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(4)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单方法是:________.
(5)补充上述步骤⑤和⑥(可提供的试剂有6 mol/L的H2SO4溶液,蒸馏水、pH试纸).
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三5月模拟测试理科综合化学试卷(解析版) 题型:填空题
(14分)铁是一种过渡元素,金属铁是最常用的金属。请回答下列各题:
(1)生铁中含有一种铁碳化合物(Fe3C),在足量的空气中高温煅烧,生成有磁性的固体和能使澄清石灰水变浑浊的气体,该反应的化学方程式为 。上述反应生成的磁性固体能溶于过量盐酸,该反应的离子方程式为 。
(2)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知,含SO2的废气通入Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。
(3)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制绿矾。利用烧渣制绿矾的过程如下:

①烧渣溶于稀H2SO4过程中,有单质硫生成,写出该反应的离子方程式(只写生成S的反应式,其他反应无需写出) 。
②向溶液X中加入足量铁屑的目的是 。
③可用硫酸酸化的 KMnO4溶液通过滴定法测定绿矾产品中FeSO4含量,滴定时发生反应的离子方程式为 。
(4)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH=3时,通过计算说明Fe3+是否沉淀完全 。
(提示:当某离子浓度小于1.0×10-5 mol•L-1时可以认为该离子沉淀完全了)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com