
 A、B、C、D、E五种元素是周期表中前四周期的元素.只有A、B、C为金属且同周期,原子序数A<B<C.A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道.D原子最外层电子数是其周期序数的三倍.E能与D形成化合物ED2,可用于自来水的消毒.
A、B、C、D、E五种元素是周期表中前四周期的元素.只有A、B、C为金属且同周期,原子序数A<B<C.A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道.D原子最外层电子数是其周期序数的三倍.E能与D形成化合物ED2,可用于自来水的消毒.分析 A、B、C为金属且同周期,原子序数A<B<C,A、C核外均没有未成对电子,据此判断A、B、C不能为前三周期元素,因为第一周期只有两种元素,第二周期只有2种金属元素,第三周期中Na与Al均存在未成对电子,故A、B、C为第四周期元素,B原子核外有二个未成对电子和三个空轨道,核外电子排布为:[Ar]4s23d2,故B为22号元素:钛;
A、C核外均没有未成对电子,原子序数A<B<C,故A为钙元素,C为锌元素;
E能与D形成化合物ED2,可用于自来水的消毒,且ED均为非金属元素,故E为氯元素,D为氧元素,据此解答各小题即可;
(1)依据元素书写价电子排布,元素的非金属性越强,其电负性越大;
(2)依据价层电子互斥理论计算判断即可;依据等电子体概念书写;
(3)依据熔沸点较低得出是分子晶体,依据分子晶体判断分子间作用力以及化学键;
(4)依据均摊法计算化学式,依据一个晶胞的质量与体积和密度的关系计算密度.
解答 解:A、B、C为金属且同周期,原子序数A<B<C,A、C核外均没有未成对电子,据此判断A、B、C不能为前三周期元素,因为第一周期只有两种元素,第二周期只有2种金属元素,第三周期中Na与Al均存在未成对电子,故A、B、C为第四周期元素,B原子核外有二个未成对电子和三个空轨道,核外电子排布为:[Ar]4s23d2,故B为22号元素:钛;
A、C核外均没有未成对电子,原子序数A<B<C,故A为钙元素,C为锌元素;
E能与D形成化合物ED2,可用于自来水的消毒,且ED均为非金属元素,故E为氯元素,D为氧元素,
(1)C为锌,Zn的基态原子的价层电子排布式为:3d104s2,元素的非金属性越强,其电负性越大,由于非金属性O>Cl,故O和Cl的电负性大小关系为:O>Cl,
故答案为:3d104s2;O;Cl;
(2)化合物E2D为Cl2O,Cl2O分子中中心原子Cl的价电子对数为$\frac{7+1}{2}$=4,中心原子有2对孤电子对,2对σ键,根据价层电子对互斥理论,空间构型为V型,依据sp3杂化,Cl与O形成三角锥结构的阴离子为:ClO3-,它的等电子体的化学式为:SO32-,故答案为:V形;sp3;ClO3-;SO32-;
(3)由题意得出:Ti与Cl形成的化合物为TiCl4,熔点低,沸点低,故该化合物应属于分子晶体,晶体内存在Ti-Cl共价键,分子晶体中存在分子间作用力,
故答案为:分子;分子键作用力、共价键;
(4)依据晶胞结构图可知,晶胞中含有Ca为:1,含有Ti为:8×$\frac{1}{8}$=1,含有O为:6×$\frac{1}{2}$=3,故该晶胞的化学式为:CaTiO3,若最近的Ti与O的原子距离为a cm,那么Ti与Ti的距离即为$\sqrt{2}$a,那么该晶胞的体积为:$(2\sqrt{2}a)^{3}$,该物质的摩尔质量为M g/mol,阿伏加德罗常数的数值为NA,则该晶体的密度为:$\frac{M}{{N}_{A}×(2\sqrt{2}a)^{3}}=\frac{\sqrt{2}M}{{N}_{A}×4{a}^{3}}$,故答案为:CaTiO3;$\frac{\sqrt{2}M}{4{a}^{3}{N}_{A}}$.
点评 本题主要考查的是位置结构性质的关系与应用,涉及晶体类型判断、晶胞计算、杂化类型判断、等电子体等,综合性较强,有一定难度.


科目:高中化学 来源: 题型:选择题

| A. | 电池工作时,Na+向负极移动 | |
| B. | 通氨气的电极1作电池的正极 | |
| C. | 电子由电极2经外电路流向电极1 | |
| D. | 燃料电池的总反应为:4NH3+3O2=2N2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol•L-1) | 0.2 | 0.1 | 0.4 |
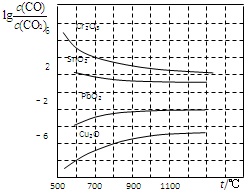
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅用酸性高锰酸钾溶液可区分苯和甲苯 | |
| B. | 仅用氯化铁溶液可区分苯酚稀溶液和甘油 | |
| C. | 仅用硝酸银溶液可验证卤代烃中卤原子的种类 | |
| D. | 仅用溴的四氯化碳溶液可区别液态的植物油和动物油 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 编号 | 实验 | 结论 |
| A | 向某溶液中加入稀盐酸,将产生的气体通入澄清石灰水,石灰水变浑浊 | 该溶液一定是碳酸盐溶液 |
| B | 用铂丝蘸取少量某溶液在酒精灯火焰上进行焰色反应,火焰呈黄色 | 该溶液不一定是钠盐溶液 |
| C | 往淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液并水浴加热,无银镜出现 | 该淀粉未发生水解 |
| D | 向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色 | 该溶液中一定含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X元素原子的半径一定小于Y元素原子的半径 | |
| B. | Y元素的氧化物不可能与X元素的气态氢化物反应 | |
| C. | X元素与氢元素形成的化合物中一定不含非极性键 | |
| D. | Y元素与X元素原子的最外层电子数一定不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 温度T/℃ | A溶液 | B溶液 |
| ① | 30 | 20mL0.1mol•L-1H2C2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
| ② | 20 | 20mL0.1mol•L-1H2S2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
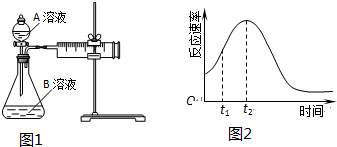
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8+$\frac{1}{2}$ lg2 | B. | 9+lg2 | C. | 10+$\frac{1}{2}$ lg2 | D. | 11+2lg2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com