
 Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| N2浓度/mol·L-1[ | 4.00 | 3.70 | 3.50 | 3.36 | 3.26 | 3.18 | 3.10 | 3.00 | 3.00 | 3.00 |
| CO浓度/mol·L-1 | 0.00 | 0.90 | 1.50 | 1.92 | 2.22 | 2.46 | 2.70 | — | — | — |
科目:高中化学 来源:不详 题型:填空题
 xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ;②开始时反应速度
;②开始时反应速度
 ;④整个反应阶段平均速度
;④整个反应阶段平均速度
| A.③④⑤⑥ | B.①③⑥⑦ | C.①②③⑥ | D.②③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
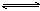 4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则下列反应速率正确的是
4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则下列反应速率正确的是| A.v(O2)=0.01mol/(L· s) | B.v(NO)=0.008mol/(L· s) |
| C.v(H2O)=0.015mol/(L· s) | D.v(NH3)=0.002mol/(L· s) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3,5s内SO3的浓度增加了0.4 mol/L,则在这段时间内用O2表示的反应速率(mol/L·s)为
2SO3,5s内SO3的浓度增加了0.4 mol/L,则在这段时间内用O2表示的反应速率(mol/L·s)为| A.0.1 | B.0.08 | C.0.04 | D.0.02 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g),如果2min内N2的浓度由6mol/L减小到2mol/L,那么用N2浓度变化来表示的该反应在这2min内的反应速率为
2NH3(g),如果2min内N2的浓度由6mol/L减小到2mol/L,那么用N2浓度变化来表示的该反应在这2min内的反应速率为| A.4 mol/L | B.2mol/(L·min) | C.6 mol/(L·min) | D.3mol/(L·min) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 E(g),当反应进行到4min时,测知M的浓度为0.2mol/L;反应进行到2min时,密闭容器中M的物质的量浓度为 ( )
E(g),当反应进行到4min时,测知M的浓度为0.2mol/L;反应进行到2min时,密闭容器中M的物质的量浓度为 ( )A.等于0.6mo l/L l/L | B.小于0.6mol/L |
| C.等于0.8mol/L | D.大于0.8mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com