
通常情况下,苯的化学性质较稳定,这是由于( )
A.苯不能使酸性KMnO4溶液褪色
B.苯不与溴水发生加成反应
C.是由苯的分子结构所决定的
D.苯是芳香烃
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.【查阅资料】
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀盐酸。
Ⅱ.【制备产品】
实验装置如图所示(省略夹持装置):

实验步骤:
(1)检查装置气密性,如图示加入试剂。
仪器a的名称是________;E中的试剂是________(选填下列字母编号)。
A.稀H2SO4
B.NaOH溶液
C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3的混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中的混合物,滤液经________(填写操作名称)、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.【探究与反思】
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,
____________________________________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(2)进行了改进,改进后的操作是______________________________________________________________________________。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过________方法提纯。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意如下:

(1)将菱锌矿研磨成粉的目_________。
(2)完成“氧化除铁”步骤中反应的离子方程式:
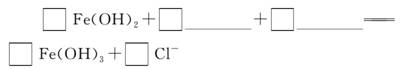
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是____________________。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为__________________。
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | — | — |
| 沉淀完全的pH | 12.4 | 8.0 | — | — |
| 开始溶解的pH | — | 10.5 | — | — |
| Ksp | 5.6×10-12 | — | 6.8×10-6 | 2.8×10-9 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是________(选填序号)。
a.大理石粉 b.石灰乳
c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为________、________、过滤、洗涤、干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
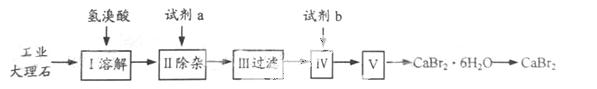
溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性 质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
完成下列填空:
35.上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸的氢溴酸500ml,所需的玻璃仪器有玻璃棒、 。
36.已知步骤Ⅲ的滤液中不含NH4+。步骤Ⅱ加入的试剂a是 ,控制溶液的pH约为8.0的目的是 、 。
37.试剂b是 ,步骤Ⅳ的目的是 。
38.步骤Ⅴ所含的操作依次是 、 。
39.制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④ ;⑤称量。若得到1.88g碳酸钙,则溴化钙的质量分数为 (保留两位小数)。
若实验操作规范而测定结果偏低,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下性质稳定,加热至560 ℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
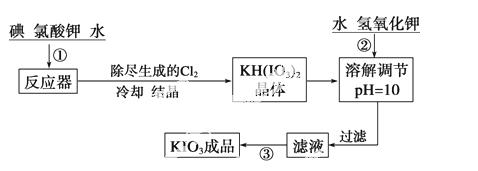
(1)已知步骤①反应器发生的反应中,单质碘和氯酸钾的物质的量之比为6∶11,则反应器中发生反应的化学方程式为
_____________________________________________________________________。
(2)步骤②中调节pH=10的目的是_______________________________________。
参照碘酸钾的溶解度:
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3 g/100 g H2O | 8.08 | 12.6 | 18.3 | 24.8 |
操作③的方法是_____________________________________________________。
(3)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应,然后用四氯化碳检验生成的碘单质时,甲应观察到的明显现象有_______________________________________________________________________。
学生乙对纯净的NaCl进行了如下实验:取1 g纯净的NaCl,加3 mL水配成溶液,然后滴入5滴淀粉溶液和1 mL 0.1 mol·L-1 KI溶液,振荡,溶液无变化,然后再滴入1滴1 mol·L-1的H2SO4,振荡,一段时间后溶液变浅蓝色。请推测实验中产生蓝色现象的可能原因,用离子方程式表示
______________________________________________________________________。
(4)学生丙查阅有关食品碘强化剂的资料后知道,碘酸钙也是一种允许使用的食品碘强化剂,它是一种白色结晶或结晶性粉末,难溶于水和乙醇。丙同学在氯化钙溶液中加入理论量的碘酸钾溶液,反应生成的沉淀经水洗后,室温下干燥得碘酸钙晶体,加热至160~540 ℃变成无水物,此时固体质量为原晶体质量的78.3%,写出制备碘酸钙晶体的离子方程式:_________________________________________________;
检验沉淀已经洗涤干净的方法是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
苯乙烯是一种重要的有机化工原料,其结构简式为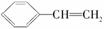 ,它一般不可能具有的性质是( )
,它一般不可能具有的性质是( )
A.易溶于水,不易溶于有机溶剂
B.在空气中燃烧产生黑烟
C .它能使溴的四氯化碳溶液褪色
.它能使溴的四氯化碳溶液褪色
D.能发生加成反应,在一定条件下可与4倍物 质的量的氢气加成
质的量的氢气加成
查看答案和解析>>
科目:高中化学 来源: 题型:
燃烧某混合气体,所产生的CO2的质量一定大于燃烧相同质量丙烯所产生的CO2的质量,该混合气体可
能是 ( )
A.丁烯、丙烯 B.乙炔、乙烯
C.乙烷、丙烷 D.乙烷、环丙烷(C3 H6)
H6)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对分子、原子、离子的认识,其中正确的是( )
A、氢原子是最小的微粒,不可再分
B、镁原子的质子数大于镁离子的质子数
C、当液态水变成冰,水分子间不存在间隔
D、分子、原子、离子都可以直接构成物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com