
| A. | $\frac{ab}{22400}$mol•L-1 | B. | $\frac{ab}{22400+17a}$mol•L-1 | ||
| C. | $\frac{1000ab}{22400+35a}$mol•L-1 | D. | $\frac{1000ab}{22400+17a}$mol•L-1 |
分析 先计算出标况下aL氨气的物质的量,然后根据溶液质量=溶质质量+溶剂质量,计算溶液质量,再依据V=$\frac{m}{ρ}$计算溶液体积,最后依据溶液物质的量浓度计算公式C=$\frac{n}{V}$计算.
解答 解:标准状况下aL氨气的物质的量为:n=$\frac{a}{22.4}$(mol);,氨气的质量为:17g/mol×$\frac{a}{22.4}$mol=$\frac{17a}{22.4}$g,
该氨水溶液的质量为:1000g+$\frac{17a}{22.4}$g,
该氨水的体积V=$\frac{m}{ρ}$=$\frac{\frac{17a}{22.4}+1000}{b×1000}$;
则氨水的物质的量浓度C=$\frac{n}{V}$=$\frac{\frac{a}{22.4}}{\frac{\frac{17a}{22.4}+1000}{1000b}}$=$\frac{1000ab}{22400+17a}$mol/L;
故选:D.
点评 本题考查了物质的量浓度计算,题目难度中等,注意掌握物质的量浓度的概念及计算方法,明确氨水溶液的体积不能用水和氨气的体积之和,试题培养了学生的化学计算能力.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:解答题
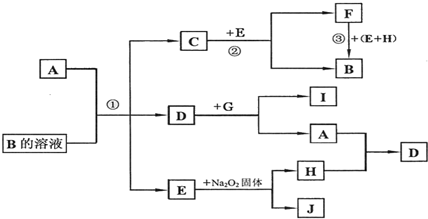
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层有4个电子的原子都是非金属原子 | |
| B. | 同一主族的两种元素的原子序数之差不可能是44 | |
| C. | COCl2分子和CCl4分子中所有原子都满足最外层8电子结构 | |
| D. | 同主族金属的原子,半径越大,熔点越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | $\frac{1}{2}$CH4(g)+O2(g)═$\frac{1}{2}$CO2(g)+H2O(l)△H=-445.15 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA较强 | B. | HB较强 | C. | 两者一样 | D. | 无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Cl2与足量Fe反应,转移的电子数为2nA | |
| B. | 19.2g纯铜理论上可以制得纯净的硝酸铜的物质的量为0.3NA | |
| C. | 1.8 gAl与足量的盐酸反应放出的氢气为0.1NA | |
| D. | 0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10nA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物稳定性HA>H2B>DH3 | B. | 原子半径A>B>D | ||
| C. | 非金属性A>B>D | D. | 阴离子还原性B2->A- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X溶液 | 现象 | 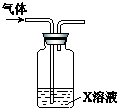 | |
| A | 紫色石蕊溶液 | 溶液先变红后褪色 | |
| B | 淀粉KI酸性溶液 | 溶液变为蓝色 | |
| C | 滴有KSCN的FeSO4溶液 | 溶液变为红色 | |
| D | 稀HNO3酸化的AgNO3溶液 | 有白色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 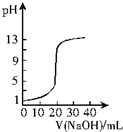 图表示0.10 mol•L-1 NaOH溶液滴定20.00 mL 0.10 mol•L-1醋酸溶液的滴定曲线 | |
| B. | 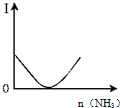 图表示乙酸溶液中通入氨气至过量过程中溶液导电性I的变化 | |
| C. | 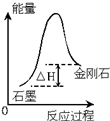 根据图所示可知:金刚石生成石墨为放热反应 | |
| D. | 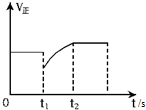 图表示反应2SO2+O2?2SO3,t1时刻只小了的SO3的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com