
X、Y、Z、W、P为短周期的主族元素,其原子序数依次增大。Y、Z、W、P位于同一周期。X元素形成的单质是自然界中含量最多的气体,1mol Y的单质分别与足量盐酸和氢氧化钠溶液反应生成的气体在标况下均为33.6L。W的原子最外层电子数与核外电子总数之比为3∶8,X的原子序数是Z的原子序数的一半。
(1)Z的原子结构示意图为 ,W与P可形成原子个数比为1∶2的化合物,其电子式为 。
(2)经测定,在2.5×1.01×105 Pa下,Y 与P形成的化合物的熔点为190℃,沸点为180℃,则该化合物为 晶体。
(3)Z、W、P三种元素的气态氢化物稳定性由高到低的顺序是 (填化学式)。
(4)Y与W形成的化合物遇水分解,发生反应的化学方程式为 。
(5)X的三氟化物是微电子工业中优良的等离子刻蚀气体,但在潮湿的环境中能与水发生反应生成无色气体,遇空气变为红棕色。该反应的化学方程式为 ,若0.6mol X的三氟化物完全反应,则转移的电子总数约为 。
(1)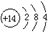
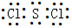 (各2分,共4分)
(各2分,共4分)
(2)分子 (2分)
(3)HCl H2S SiH4 (2分)
(4)Al2S3 + 6H2O 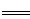 2Al(OH)3↓ +3H2S↑ (2分)
2Al(OH)3↓ +3H2S↑ (2分)
(5)3NF3+5H2O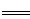 2NO+HNO3+9HF 2.408×1023
(各2分,共4分)
2NO+HNO3+9HF 2.408×1023
(各2分,共4分)
【解析】
试题分析:X元素形成的单质是自然界中含量最多的气体,X为N元素;1mol Y的单质分别与足量盐酸和氢氧化钠溶液反应生成的气体在标况下均为33.6L,Y为Al元素,W的原子最外层电子数与核外电子总数之比为3∶8,W为S元素;X的原子序数是Z的原子序数的一半,Z为Si元素;又因为X、Y、Z、W、P为短周期的主族元素,其原子序数依次增大。Y、Z、W、P位于同一周期,P为Cl元素。
(1)SCl2电子式为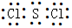 ,因为氯最外层7个电子因此需要共用1对电子,硫最外层有6个电子,需要共用2对,所以是一个硫和2个氯一边共用一对;
,因为氯最外层7个电子因此需要共用1对电子,硫最外层有6个电子,需要共用2对,所以是一个硫和2个氯一边共用一对;
(2)分子晶体是由分子构成,分子间的作用力很弱,具有较低的熔点、沸点、硬度小、易挥发等性质;
(3)气态氢化物中稳定性最弱取决于元素非金属性的强弱,元素的非金属性越强,对应氢化物越稳定;
(4)铝离子和硫离子双水解可以得到氢氧化铝和硫化氢;
(5)用化合价升降法来配平,3NF3+5H2O=2NO+HNO3+9HF反应中,只有N元素的化合价发生变化,NF3既是氧化剂又是还原剂,从化合价的变化的角度分析此氧化还原反应,3molNF3完全反应转移了2mole-,所以0.6mol X的三氟化物完全反应,则转移的电子总数约为2.408×1023。
考点:考查原子结构与元素周期律的关系。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省唐山市高三4月第二次模拟理综化学试卷(解析版) 题型:推断题
X、Y、Z、W、R为前四周期原子序数依次增大的五种元素,X、Y、Z、W为同一周期相邻元素,Z元素原子核外电子的运动状态共有8种;R元素与比它核电荷数大的另外两种元素位于第四周期同一族。
(1)X的一种核素用于鉴定文物年代,该核素的符号为____。
(2)X、Y、Z、W四种元素第一电离能由大到小的顺序为____(用元素符号表示)。
(3)用氢键表示式写出W的气态氢化物水溶液中不同种分子间存在的氢键____。
(4)Y的一种氢化物分子中共有18个电子,该分子中存在的共价键类型有____(填选项字母)。
A.非极性键;B.极性键;C. 键;D.
键;D. 键;E.p—p
键;E.p—p 键;F.
键;F. 键;G.
键;G. 键;H.
键;H.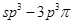 键
键
(5)R的基态原子的价层电子排布式为____,R元素位于周期表的____区。
(6)R单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如下图所示:

图A中原子堆积方式为 ,A、B中R原子的配位数之比为____。A、B晶胞的棱长分别为a cm和b cm,则A、B两种晶体的密度之比为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com